Matemática
Ex.: metano; etano.; propano; butano (CH4; C2H6; C3H8; C4H10); Fórmula Geral: CnH2n+2. Metanol; etanol; 1-propanol; 1-butanol (CH4O; C2H6O; C3H8O; C4H10O); Fórmula Geral: CnH2n+2O.
Obs.: As propriedades físicas dos compostos de uma série homóloga variam uniformemente;
01.2. SÉRIE ISÓLOGA: é um conjunto de compostos da mesma função orgânica que diferem entre si em um ou mais H2.
Ex.: etano; eteno; etino (C2H6; C2H4; C2H2); ciclopentano; ciclopenteno; ciclopentadieno (C5H10; C5H8; C5H6).
01.3. SÉRIE HETERÓLOGA: é um conjunto de compostos provenientes de funções orgânicas diferentes, mas tendo em comum o mesmo número de átomos de carbono. Ex.: tolueno; ácido benzóico; aldeído benzóico; cianeto de fenila (C6H8; C6H6O; C6H6O2; C6H5N).
Isômeros: são compostos com a mesma fórmula molecular, mas com arranjos atômicos diferentes; portanto com propriedades diferentes.
Isomeria Plana: é aquela em que os compostos apresentam diferentes fórmulas estruturais planas, portanto a diferença dos compostos é visível no plano.
Isomeria espacial: é aquela em que os compostos têm a mesma fórmula plana, mas estruturas espaciais diferentes.
Obs.: A Isomeria pode ser Plana ou Espacial. A Isomeria Plana pode ser: de cadeia, de posição, de compensação ou metameria, de função ou funcional, dinâmica ou tautomeria. A Isomeria Espacial se divide em Isomeria Geométrica ou Cis-Trans e em Isomeria Óptica.
02.1. ISOMERIA PLANA
I) Isomeria de cadeia: caracteriza-se por apresentar isômeros da mesma função orgânica que apresentam números diferentes de átomos de carbono na cadeia principal.
Obs.: No caso dos compostos cíclicos essa isomeria pode também ser chamada de isomeria de núcleo ou de anel;
II) Isomeria de posição: caracteriza-se por apresentar isômeros da mesma função orgânica que apresentam a mesma cadeia principal, mas que possuem grupos funcionais ou duplas e triplas ligações em posições diferentes;
III) Isomeria de compensação ou Metameria: caracteriza-se por apresentar isômeros da mesma função orgânica, mas que apresenta um heteroátomo em diferentes posições na cadeia carbônica;
Obs.: Heteroátomo é um átomo diferente de carbono entre dois carbonos, geralmente: O, S, N, P etc.
Obs.: O hidrogênio nunca será um heteroátomo;
IV) Isomeria de função ou Funcional: caracteriza-se por apresentar isômeros de funções orgânicas diferentes.
Ex.: aldeído e cetona; ácido carboxílico e éster; fenol e éter aromático e álcool aromático.
V) Isomeria dinâmica ou Tautomeria: caracteriza-se por apresentar isômeros de funções orgânicas diferentes, mas que se transformam um no outro quando em solução, através de um equilíbrio dinâmico.
Obs.: Ocorre geralmente entre: aldeído e enol (equilíbrio aldo-enólico), cetona e enol (equilíbrio ceto-enólico).
Obs.: enol é uma função orgânica caracterizada pela presença da hidroxila (OH) ligada a um carbono com dupla ligação, o que o diferencia de um álcool, pois como vimos possui hidroxila ligada a carbono saturado.
02.2. ISOMERIA ESPACIAL OU ESTEREOISOMERIA
02.2.1. ISOMERIA GEOMÉTRICA OU CIS-TRANS
I) Em compostos de cadeia acíclica
Ocorre quando átomos ou grupos de átomos diferentes se unem a cada um dos átomos de carbono de uma dupla ligação.
 Obs.: este par de estruturas análogas representa substâncias quimicamente diferentes, já que uma molécula não pode ser convertida na outra por causa da rotação impedida entre os carbonos.
Obs.: este par de estruturas análogas representa substâncias quimicamente diferentes, já que uma molécula não pode ser convertida na outra por causa da rotação impedida entre os carbonos.
Obs.: nos compostos que apresentam quatro ligantes diferentes nos carbonos de rotação impedida, considera-se isômero CIS o que contém os grupos maiores do mesmo lado.
Obs.: de um modo geral, os isômeros cis-trans apresentam as mesmas propriedades químicas, porém têm diferentes propriedades físicas. As propriedades químicas serão diferentes quando dependerem das posições relativas dos grupos; se estas posições forem diferentes, as propriedades químicas dos isômeros também o serão.
Obs.: Verifica-se que as formas trans são mais estáveis que as respectivas formas cis, o que se explica pela menor repulsão entre os grupos na posição trans.
II) Em Compostos de Cadeia Cíclica (Isomeria de Baeyer ou Baeyeriana)
Quando átomos de carbono estiverem ligados num ciclo jamais poderão sofrer uma rotação completa em trono de seus eixos sem quebrar o ciclo, logo para que haja isomeria geométrica basta que pelo menos dois carbonos do ciclo possuam ligantes diferentes entre si.
 02.2. 2. ISOMERIA ÓPTICA
02.2. 2. ISOMERIA ÓPTICA
Isômeros ópticos: são aqueles cuja a única diferença está no comportamento diante de uma luz polarizada (luz polarizada é aquela que vibra em um único sentido). Para que um composto orgânico seja opticamente ativo é necessário que suas moléculas seja assimétricas, ou seja, suas moléculas devem possuir carbono assimétrico, que é o carbono que possui os quatro ligantes diferentes, ou seja, carbono com ligação dupla ou tripla nunca pode ser assimétrico. O carbono assimétrico ou quiral é representado por C*.
Substância opticamente ativa: é aquela que desvia o plano de luz polarizada, se o desvio for para a direita dizemos que é dextrógiro e se o desvio for para a esquerda dizemos que é levógiro.
Substância opticamente inativa: é aquela que não desvia o plano de luz polarizada.
Mistura racêmica: é opticamente inativa por compensação externa, ou seja como há um número igual de molécula provocando desvios contrários na luz polarizada, uma cancela o desvio da outra e o desvio final é nulo.
Enantiomorfos, Antípodas ópticos ou Enanciômeros: são compostos que são imagens especulares um do outro, ou seja não são superponíveis, desviam a luz polarizada de um mesmo ângulo (ativos), só que para lados opostos.
Diasteroisômeros: são isômeros ópticos não enantiomorfos entre si, ou seja, não são imagens especulares um do outro, desviam a luz polarizada em Ângulos diferentes (ativos) e só ocorrem em compostos com mais de um C* na molécula.
Obs.: as mãos direita e esquerda são imagens especulares uma da outra e não são superponíveis, por isso são assimétrica.
Isômero Meso: é um isômero inativo por compensação interna, ou seja é um composto que possui dois carbonos assimétricos (2C*) com ligantes iguais e um dos carbonos desvia a luz polarizada de um ângulo µ para a direita e o outro C* desvia a luz polarizada de um ângulo µ para a esquerda, portanto o desvio final será nulo.
1.º Caso: Moléculas com um C*: possuem três isômeros: um dextrógiro, um levógiro e um racêmico (formado por quantidades equimolares do dextrógiro e do levógiro).
2.º Caso: Moléculas com dois C* iguais: possuem quatro isômeros: um dextrógiro, um levógiro, um racêmico e um meso ou mesógiro (inativo por compensação interna).
3.º Caso: Moléculas que possuem "n" carbonos assimétricos diferentes:
1.º Caso: Moléculas de alcadienos acumulados ou compostos alênicos
Os alcadieno acumulados são compostos que possuem duas ligações duplas seguidas.
 Observando a geometria espacial destes tipos de compostos veremos que não possuem um plano de simetria, ou seja, são assimétricos, consequentemente apresentam atividade óptica e possuem dois isômeros, o dextrógiro e o levógiro e consequentemente uma mistura racêmica.
Observando a geometria espacial destes tipos de compostos veremos que não possuem um plano de simetria, ou seja, são assimétricos, consequentemente apresentam atividade óptica e possuem dois isômeros, o dextrógiro e o levógiro e consequentemente uma mistura racêmica.
2.º Caso: Moléculas Cíclicas com Isomeria Trans.
Quando um composto de cadeia carbônica cíclica apresenta isomeria geométrica, a molécula do isômero trans é assimétrica, isto é, não apresenta plano de simetria e portanto possui atividade óptica, apresentando dois isômero, o dextrógiro, o levógiro e também uma mistura racêmica.
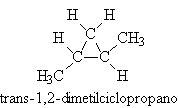 Obs.: O isômero cis apresenta plano de simetria, portanto é opticamente inativo.
Obs.: O isômero cis apresenta plano de simetria, portanto é opticamente inativo.
- Compostos Orgânicos: Características Gerais
Líria Alves A cetona é um composto orgânicoOs compostos orgânicos em sua maioria são formados pela ligação entre átomos de carbono e hidrogênio. Sendo assim, a atração entre elétrons das moléculas orgânicas é praticamente...
- Hidrocarbonetos
Hidrocarbonetos são compostos formados exclusivamente de carbono e hidrogênio, que também são chamados hidrocarburetos, carboidretos, carbetos, carburetos ou carbonetos de hidrogênio. Os fogos sagrados de Baku, capital do Azerbaijão, situada à...
- Isomeria Isômeros De Constituição E Estereoisômeros
Professor de Matemática e Biologia Antônio Carlos Carneiro BarrosoColégio Estadual Dinah Gonçalvesemail [email protected] www.ensinodematemtica.blogspot.com.brwww.accbarrosogestar.blogspot.com.br WWW.profantoniocarneiro.com ...
- Classificação Das Cadeias Carbônicas
Classificação das Cadeias CarbônicasLíria Alves Cadeia carbônica mistaOs átomos de carbono possuem a capacidade de se agrupar formando estruturas, essa capacidade é a principal responsável pela existência de milhões de...
- Compostos Orgânicos Fórmulas Estruturais E Principais Classes
Professor de Matemática e Biologia Antônio Carlos Carneiro BarrosoColégio Estadual Dinah Gonçalvesemail [email protected] www.ensinodematemtica.blogspot.com.brwww.accbarrosogestar.blogspot.com.br WWW.profantoniocarneiro.com Os humanos...
Matemática
Isomeria
01. SÉRIES ORGÂNICAS
01.1. SÉRIE HOMÓLOGA: é um conjunto de compostos de mesma função orgânica, que diferem entre si em um ou mais grupos CH2. Ex.: metano; etano.; propano; butano (CH4; C2H6; C3H8; C4H10); Fórmula Geral: CnH2n+2. Metanol; etanol; 1-propanol; 1-butanol (CH4O; C2H6O; C3H8O; C4H10O); Fórmula Geral: CnH2n+2O.
Obs.: As propriedades físicas dos compostos de uma série homóloga variam uniformemente;
01.2. SÉRIE ISÓLOGA: é um conjunto de compostos da mesma função orgânica que diferem entre si em um ou mais H2.
Ex.: etano; eteno; etino (C2H6; C2H4; C2H2); ciclopentano; ciclopenteno; ciclopentadieno (C5H10; C5H8; C5H6).
01.3. SÉRIE HETERÓLOGA: é um conjunto de compostos provenientes de funções orgânicas diferentes, mas tendo em comum o mesmo número de átomos de carbono. Ex.: tolueno; ácido benzóico; aldeído benzóico; cianeto de fenila (C6H8; C6H6O; C6H6O2; C6H5N).
02. ISOMERIA
Isomeria: é o fenômeno pelo qual o mesmo grupo de átomos dá origem a substâncias diferentes devido a arranjos atômicos diferentes. Isômeros: são compostos com a mesma fórmula molecular, mas com arranjos atômicos diferentes; portanto com propriedades diferentes.
Isomeria Plana: é aquela em que os compostos apresentam diferentes fórmulas estruturais planas, portanto a diferença dos compostos é visível no plano.
Isomeria espacial: é aquela em que os compostos têm a mesma fórmula plana, mas estruturas espaciais diferentes.
Obs.: A Isomeria pode ser Plana ou Espacial. A Isomeria Plana pode ser: de cadeia, de posição, de compensação ou metameria, de função ou funcional, dinâmica ou tautomeria. A Isomeria Espacial se divide em Isomeria Geométrica ou Cis-Trans e em Isomeria Óptica.
02.1. ISOMERIA PLANA
I) Isomeria de cadeia: caracteriza-se por apresentar isômeros da mesma função orgânica que apresentam números diferentes de átomos de carbono na cadeia principal.
Obs.: No caso dos compostos cíclicos essa isomeria pode também ser chamada de isomeria de núcleo ou de anel;
II) Isomeria de posição: caracteriza-se por apresentar isômeros da mesma função orgânica que apresentam a mesma cadeia principal, mas que possuem grupos funcionais ou duplas e triplas ligações em posições diferentes;
III) Isomeria de compensação ou Metameria: caracteriza-se por apresentar isômeros da mesma função orgânica, mas que apresenta um heteroátomo em diferentes posições na cadeia carbônica;
Obs.: Heteroátomo é um átomo diferente de carbono entre dois carbonos, geralmente: O, S, N, P etc.
Obs.: O hidrogênio nunca será um heteroátomo;
IV) Isomeria de função ou Funcional: caracteriza-se por apresentar isômeros de funções orgânicas diferentes.
Ex.: aldeído e cetona; ácido carboxílico e éster; fenol e éter aromático e álcool aromático.
V) Isomeria dinâmica ou Tautomeria: caracteriza-se por apresentar isômeros de funções orgânicas diferentes, mas que se transformam um no outro quando em solução, através de um equilíbrio dinâmico.
Obs.: Ocorre geralmente entre: aldeído e enol (equilíbrio aldo-enólico), cetona e enol (equilíbrio ceto-enólico).
Obs.: enol é uma função orgânica caracterizada pela presença da hidroxila (OH) ligada a um carbono com dupla ligação, o que o diferencia de um álcool, pois como vimos possui hidroxila ligada a carbono saturado.
02.2. ISOMERIA ESPACIAL OU ESTEREOISOMERIA
02.2.1. ISOMERIA GEOMÉTRICA OU CIS-TRANS
I) Em compostos de cadeia acíclica
Ocorre quando átomos ou grupos de átomos diferentes se unem a cada um dos átomos de carbono de uma dupla ligação.

Obs.: nos compostos que apresentam quatro ligantes diferentes nos carbonos de rotação impedida, considera-se isômero CIS o que contém os grupos maiores do mesmo lado.
Obs.: de um modo geral, os isômeros cis-trans apresentam as mesmas propriedades químicas, porém têm diferentes propriedades físicas. As propriedades químicas serão diferentes quando dependerem das posições relativas dos grupos; se estas posições forem diferentes, as propriedades químicas dos isômeros também o serão.
Obs.: Verifica-se que as formas trans são mais estáveis que as respectivas formas cis, o que se explica pela menor repulsão entre os grupos na posição trans.
II) Em Compostos de Cadeia Cíclica (Isomeria de Baeyer ou Baeyeriana)
Quando átomos de carbono estiverem ligados num ciclo jamais poderão sofrer uma rotação completa em trono de seus eixos sem quebrar o ciclo, logo para que haja isomeria geométrica basta que pelo menos dois carbonos do ciclo possuam ligantes diferentes entre si.

Isômeros ópticos: são aqueles cuja a única diferença está no comportamento diante de uma luz polarizada (luz polarizada é aquela que vibra em um único sentido). Para que um composto orgânico seja opticamente ativo é necessário que suas moléculas seja assimétricas, ou seja, suas moléculas devem possuir carbono assimétrico, que é o carbono que possui os quatro ligantes diferentes, ou seja, carbono com ligação dupla ou tripla nunca pode ser assimétrico. O carbono assimétrico ou quiral é representado por C*.
Substância opticamente ativa: é aquela que desvia o plano de luz polarizada, se o desvio for para a direita dizemos que é dextrógiro e se o desvio for para a esquerda dizemos que é levógiro.
Substância opticamente inativa: é aquela que não desvia o plano de luz polarizada.
Mistura racêmica: é opticamente inativa por compensação externa, ou seja como há um número igual de molécula provocando desvios contrários na luz polarizada, uma cancela o desvio da outra e o desvio final é nulo.
Enantiomorfos, Antípodas ópticos ou Enanciômeros: são compostos que são imagens especulares um do outro, ou seja não são superponíveis, desviam a luz polarizada de um mesmo ângulo (ativos), só que para lados opostos.
Diasteroisômeros: são isômeros ópticos não enantiomorfos entre si, ou seja, não são imagens especulares um do outro, desviam a luz polarizada em Ângulos diferentes (ativos) e só ocorrem em compostos com mais de um C* na molécula.
Obs.: as mãos direita e esquerda são imagens especulares uma da outra e não são superponíveis, por isso são assimétrica.
Isômero Meso: é um isômero inativo por compensação interna, ou seja é um composto que possui dois carbonos assimétricos (2C*) com ligantes iguais e um dos carbonos desvia a luz polarizada de um ângulo µ para a direita e o outro C* desvia a luz polarizada de um ângulo µ para a esquerda, portanto o desvio final será nulo.
1.º Caso: Moléculas com um C*: possuem três isômeros: um dextrógiro, um levógiro e um racêmico (formado por quantidades equimolares do dextrógiro e do levógiro).
2.º Caso: Moléculas com dois C* iguais: possuem quatro isômeros: um dextrógiro, um levógiro, um racêmico e um meso ou mesógiro (inativo por compensação interna).
3.º Caso: Moléculas que possuem "n" carbonos assimétricos diferentes:
A. n.º de isômeros ópticos ativos: 2n (Obs.: fórmulas de Van't Hoff)I - Moléculas Assimétricas que não possuem Carbono Assimétrico
B. n.º de isômeros ópticos inativos: 2n-1 (o que corresponde à metade dos ativos, pois aqueles se reúnem dois a dois para formar os inativos correspondentes)
C. n.º de isômeros ópticos dextrógiros: 2n-1 (o que corresponde à metade dos ativos)
D. n.º de isômeros ópticos levógiros: 2n-1 (o que corresponde à metade dos ativos)
E. n.º de misturas racêmicas: 2n-1 (o que corresponde à metade dos ativos)
F. n.º de isômeros ópticos: 2n + 2n-1 ou 3. 2n-1(o que corresponde à soma dos ativos com os inativos)
1.º Caso: Moléculas de alcadienos acumulados ou compostos alênicos
Os alcadieno acumulados são compostos que possuem duas ligações duplas seguidas.

2.º Caso: Moléculas Cíclicas com Isomeria Trans.
Quando um composto de cadeia carbônica cíclica apresenta isomeria geométrica, a molécula do isômero trans é assimétrica, isto é, não apresenta plano de simetria e portanto possui atividade óptica, apresentando dois isômero, o dextrógiro, o levógiro e também uma mistura racêmica.

- Compostos Orgânicos: Características Gerais
Líria Alves A cetona é um composto orgânicoOs compostos orgânicos em sua maioria são formados pela ligação entre átomos de carbono e hidrogênio. Sendo assim, a atração entre elétrons das moléculas orgânicas é praticamente...
- Hidrocarbonetos
Hidrocarbonetos são compostos formados exclusivamente de carbono e hidrogênio, que também são chamados hidrocarburetos, carboidretos, carbetos, carburetos ou carbonetos de hidrogênio. Os fogos sagrados de Baku, capital do Azerbaijão, situada à...
- Isomeria Isômeros De Constituição E Estereoisômeros
Professor de Matemática e Biologia Antônio Carlos Carneiro BarrosoColégio Estadual Dinah Gonçalvesemail [email protected] www.ensinodematemtica.blogspot.com.brwww.accbarrosogestar.blogspot.com.br WWW.profantoniocarneiro.com ...
- Classificação Das Cadeias Carbônicas
Classificação das Cadeias CarbônicasLíria Alves Cadeia carbônica mistaOs átomos de carbono possuem a capacidade de se agrupar formando estruturas, essa capacidade é a principal responsável pela existência de milhões de...
- Compostos Orgânicos Fórmulas Estruturais E Principais Classes
Professor de Matemática e Biologia Antônio Carlos Carneiro BarrosoColégio Estadual Dinah Gonçalvesemail [email protected] www.ensinodematemtica.blogspot.com.brwww.accbarrosogestar.blogspot.com.br WWW.profantoniocarneiro.com Os humanos...
