Matemática
É provável que nas suas aulas de ciências no ensino fundamental você tenha aprendido três estados físicos da matéria, o sólido, o líquido e o gasoso.
Esses estados físicos vêm do estado de agregação das moléculas constituintes da matéria. Se elas estão fortemente ligadas e com uma liberdade de movimento restrita a apenas agitações em torno de um ponto de equilíbrio, teremos nessa situação o estado sólido.
Com grau de liberdade de movimento maior, mas com alguma restrição, pois ainda há forças entre as moléculas, teremos o estado líquido e com um grau ainda maior de liberdade, pois as forças entre as moléculas são praticamente desprezíveis, teremos o estado gasoso.
Uma substância pode se apresentar em qualquer um desses estados físicos dependendo das condições de temperatura e pressão a que é submetida. Uma maneira muito comum de se mudar o estado físico de uma substância é pelo aquecimento, ou seja, pela troca de calor dessa substância com alguma fonte térmica.
Vamos estudar os processos de mudança de estado físico, assim como as leis que regem esse fenômeno.
Fusão e solidificação
Quando uma substância se encontra no estado sólido e começa receber calor, a sua temperatura aumenta, assim como o estado de agitação das suas moléculas. Se continuarmos com esse aquecimento, a agitação molecular se tornará tão intensa que as ligações entre as moléculas irão se romper.
A partir desse momento, a energia que está sendo transferida na forma de calor não será mais utilizada para o aumento da agitação molecular, mas sim, para a quebra das ligações moleculares. Essa quebra nas ligações moleculares dará as moléculas uma maior liberdade de movimento, caracterizando a fusão ou passagem para o estado liquido.
Solidificação
A solidificação é o processo inverso da fusão. Considere que uma substância no estado líquido esteja cedendo calor. Ao ceder calor, a sua temperatura irá diminuir, assim como o estado de movimentação das moléculas. Essa diminuição da movimentação molecular fará que as ligações moleculares se tornem mais intensas, caracterizando o estado sólido.
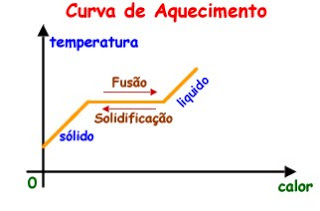
A figura abaixo representa os dois processos descritos acima na forma de um gráfico:
Página 3
Observe pelo gráfico que, durante a mudança de estado, a substância permanece com a temperatura constante.
Vaporização
Se a substância do item anterior estiver no estado líquido e continuarmos a fornecer calor, a sua temperatura irá aumentar. Com isso, haverá um aumento no grau de movimentação das moléculas.
Em determinada temperatura, essas moléculas terão energia suficiente para escapar das forças moleculares que ainda existem entre elas e atingir um grau de liberdade maior. Nesse novo estado, conhecido como gasoso, as forças entre as moléculas são praticamente desprezíveis.
A vaporização pode ocorrer de três maneiras: evaporação, ebulição e calefação.
# Evaporação:
Esse processo ocorre de maneira bem lenta e à temperatura ambiente. Pode se tomar como exemplo a evaporação da água da roupa que é deixada no varal para secar.
# Ebulição:
É um processo mais rápido que ocorre a uma temperatura fixa. Tal processo é facilmente observado quando se coloca a água para ferver.
# Calefação:
É o processo mais rápido e ocorre quando a fonte de calor está a uma temperatura muito maior do que a temperatura de ebulição da substância. Tome como exemplo uma gota de água sobre uma chapa muito quente.
Condensação
É o processo inverso da vaporização. Ao se diminuir a temperatura do gás, ele começa a perder a sua energia de movimentação. Com isso, as moléculas se agrupam através das forças moleculares, fazendo que a substância entre no estado líquido.
Curva de aquecimento
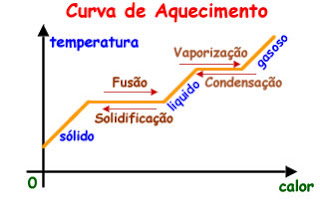
A figura a seguir mostra como uma substância inicialmente do estado sólido se comporta ao ser aquecida até atingir o estado gasoso. O gráfico a seguir é conhecido como curva de aquecimento.
#
Sublimação
A passagem direta do estado sólido para o estado gasoso sem passar pelo estado líquido é definida como sublimação. Tal processo só ocorre em condições adequadas de pressão e temperatura. É um processo de difícil observação no dia a dia. Temos como exemplos mais famosos desse fenômeno a naftalina e o gelo seco.
As leis gerais da mudança de estado
Pelo gráfico anterior podemos observar que as mudanças de estado físico são caracterizadas por patamares. Isso nos mostra que, durante essa situação, a temperatura da substância permanece constante. Desse fato, podemos enunciar a primeira lei geral das mudanças de estado:
# 1ª lei: "Durante a mudança de estado, se a substância estiver à pressão constante, a temperatura de mudança de estado permanecerá constante".
Tal fenômeno pode ser explicado pelo fato de que, na mudança de estado físico, como, por exemplo, por aquecimento, a energia que é absorvida pela substância em forma de calor não está sendo usada para o aumento da agitação molecular, mas para a quebra das ligações entre as moléculas.
Observando o enunciado da primeira lei temos algo importante a ser analisado. A temperatura permanece constante se a pressão se mantiver constante. A partir desse ponto, podemos concluir que, se mudarmos a pressão sobre a substância, também mudaremos a sua temperatura de mudança de estado. Então podemos enunciar a segunda lei geral das mudanças de estado.
# 2ª lei: "Se a pressão sobre a substância variar, a temperatura de mudança de estado também irá variar".
Um exemplo da aplicação dessa lei ocorre quando fervemos água em região litorânea. Nesse caso, a água irá ferver à temperatura de 100°C, pois a pressão ambiente ao nível do mar é de um atmosfera. Mas se fervermos a água em uma cidade como São Paulo, teremos a ebulição a uma temperatura de 98°C, pois nessa cidade a pressão ambiente é menor que um atmosfera.
* Paulo Augusto Bisquolo é professor de física do colégio COC-Santos (SP).
- Mudanças De Estado Físico
Professor de Matemática no Colégio Estadual Dinah Gonçalves E Biologia na rede privada de Salvador-Bahia Professor Antonio Carlos carneiro Barroso www.accbarrosogestar.wordpress.com email [email protected] HTTP://ensinodematemtica.blogspot.com...
- Os Estados Físicos Da água
A água pode ser encontrada em três estados físicos: A água pode mudar de estado físico como, por exemplo, ir do estado sólido para o líquido. Um exemplo disso é quando deixamos o gelo (estado sólido da água) fora da geladeira e ele derrete...
- Estados Físicos Da Matéria
Estados físicos da matéria Quando nos referimos à água, a idéia que nos vem de imediato à mente é a de um líquido fresco e incolor. Quando nos referimos ao ferro, imaginamos um sólido duro. Já o ar nos remete à idéia de matéria no estado...
- Calor Sensível E Calor Latente
Professor de Matemática no Colégio Estadual Dinah Gonçalves E Biologia na rede privada de Salvador-Bahia Professor Antonio Carlos carneiro Barroso email [email protected] HTTP://ensinodematemtica.blogspot.com e HTTP://accbarroso60.wordpress.com...
- Pressão Máxima De Vapor E Vaporização
Por que quando uma pessoa assopra sobre a superfície de um líquido a evaporação aumenta? O sopro retira o vapor que está sobre o líquido, fazendo com que a pressão sobre as moléculas da superfície diminua e, assim, elas passem para o estado...
Matemática
Mudanças de estado físico -b Fusão, solidificação, vaporização, sublimação e condensação
É provável que nas suas aulas de ciências no ensino fundamental você tenha aprendido três estados físicos da matéria, o sólido, o líquido e o gasoso.
Esses estados físicos vêm do estado de agregação das moléculas constituintes da matéria. Se elas estão fortemente ligadas e com uma liberdade de movimento restrita a apenas agitações em torno de um ponto de equilíbrio, teremos nessa situação o estado sólido.
Com grau de liberdade de movimento maior, mas com alguma restrição, pois ainda há forças entre as moléculas, teremos o estado líquido e com um grau ainda maior de liberdade, pois as forças entre as moléculas são praticamente desprezíveis, teremos o estado gasoso.
Uma substância pode se apresentar em qualquer um desses estados físicos dependendo das condições de temperatura e pressão a que é submetida. Uma maneira muito comum de se mudar o estado físico de uma substância é pelo aquecimento, ou seja, pela troca de calor dessa substância com alguma fonte térmica.
Vamos estudar os processos de mudança de estado físico, assim como as leis que regem esse fenômeno.
Fusão e solidificação
Quando uma substância se encontra no estado sólido e começa receber calor, a sua temperatura aumenta, assim como o estado de agitação das suas moléculas. Se continuarmos com esse aquecimento, a agitação molecular se tornará tão intensa que as ligações entre as moléculas irão se romper.
A partir desse momento, a energia que está sendo transferida na forma de calor não será mais utilizada para o aumento da agitação molecular, mas sim, para a quebra das ligações moleculares. Essa quebra nas ligações moleculares dará as moléculas uma maior liberdade de movimento, caracterizando a fusão ou passagem para o estado liquido.
Solidificação
A solidificação é o processo inverso da fusão. Considere que uma substância no estado líquido esteja cedendo calor. Ao ceder calor, a sua temperatura irá diminuir, assim como o estado de movimentação das moléculas. Essa diminuição da movimentação molecular fará que as ligações moleculares se tornem mais intensas, caracterizando o estado sólido.
A figura abaixo representa os dois processos descritos acima na forma de um gráfico:

Página 3
Observe pelo gráfico que, durante a mudança de estado, a substância permanece com a temperatura constante.
Vaporização
Se a substância do item anterior estiver no estado líquido e continuarmos a fornecer calor, a sua temperatura irá aumentar. Com isso, haverá um aumento no grau de movimentação das moléculas.
Em determinada temperatura, essas moléculas terão energia suficiente para escapar das forças moleculares que ainda existem entre elas e atingir um grau de liberdade maior. Nesse novo estado, conhecido como gasoso, as forças entre as moléculas são praticamente desprezíveis.
A vaporização pode ocorrer de três maneiras: evaporação, ebulição e calefação.
# Evaporação:
Esse processo ocorre de maneira bem lenta e à temperatura ambiente. Pode se tomar como exemplo a evaporação da água da roupa que é deixada no varal para secar.
# Ebulição:
É um processo mais rápido que ocorre a uma temperatura fixa. Tal processo é facilmente observado quando se coloca a água para ferver.
# Calefação:
É o processo mais rápido e ocorre quando a fonte de calor está a uma temperatura muito maior do que a temperatura de ebulição da substância. Tome como exemplo uma gota de água sobre uma chapa muito quente.
Condensação
É o processo inverso da vaporização. Ao se diminuir a temperatura do gás, ele começa a perder a sua energia de movimentação. Com isso, as moléculas se agrupam através das forças moleculares, fazendo que a substância entre no estado líquido.
Curva de aquecimento
A figura a seguir mostra como uma substância inicialmente do estado sólido se comporta ao ser aquecida até atingir o estado gasoso. O gráfico a seguir é conhecido como curva de aquecimento.

#
Sublimação
A passagem direta do estado sólido para o estado gasoso sem passar pelo estado líquido é definida como sublimação. Tal processo só ocorre em condições adequadas de pressão e temperatura. É um processo de difícil observação no dia a dia. Temos como exemplos mais famosos desse fenômeno a naftalina e o gelo seco.
As leis gerais da mudança de estado
Pelo gráfico anterior podemos observar que as mudanças de estado físico são caracterizadas por patamares. Isso nos mostra que, durante essa situação, a temperatura da substância permanece constante. Desse fato, podemos enunciar a primeira lei geral das mudanças de estado:
# 1ª lei: "Durante a mudança de estado, se a substância estiver à pressão constante, a temperatura de mudança de estado permanecerá constante".
Tal fenômeno pode ser explicado pelo fato de que, na mudança de estado físico, como, por exemplo, por aquecimento, a energia que é absorvida pela substância em forma de calor não está sendo usada para o aumento da agitação molecular, mas para a quebra das ligações entre as moléculas.
Observando o enunciado da primeira lei temos algo importante a ser analisado. A temperatura permanece constante se a pressão se mantiver constante. A partir desse ponto, podemos concluir que, se mudarmos a pressão sobre a substância, também mudaremos a sua temperatura de mudança de estado. Então podemos enunciar a segunda lei geral das mudanças de estado.
# 2ª lei: "Se a pressão sobre a substância variar, a temperatura de mudança de estado também irá variar".
Um exemplo da aplicação dessa lei ocorre quando fervemos água em região litorânea. Nesse caso, a água irá ferver à temperatura de 100°C, pois a pressão ambiente ao nível do mar é de um atmosfera. Mas se fervermos a água em uma cidade como São Paulo, teremos a ebulição a uma temperatura de 98°C, pois nessa cidade a pressão ambiente é menor que um atmosfera.
* Paulo Augusto Bisquolo é professor de física do colégio COC-Santos (SP).
- Mudanças De Estado Físico
Professor de Matemática no Colégio Estadual Dinah Gonçalves E Biologia na rede privada de Salvador-Bahia Professor Antonio Carlos carneiro Barroso www.accbarrosogestar.wordpress.com email [email protected] HTTP://ensinodematemtica.blogspot.com...
- Os Estados Físicos Da água
A água pode ser encontrada em três estados físicos: A água pode mudar de estado físico como, por exemplo, ir do estado sólido para o líquido. Um exemplo disso é quando deixamos o gelo (estado sólido da água) fora da geladeira e ele derrete...
- Estados Físicos Da Matéria
Estados físicos da matéria Quando nos referimos à água, a idéia que nos vem de imediato à mente é a de um líquido fresco e incolor. Quando nos referimos ao ferro, imaginamos um sólido duro. Já o ar nos remete à idéia de matéria no estado...
- Calor Sensível E Calor Latente
Professor de Matemática no Colégio Estadual Dinah Gonçalves E Biologia na rede privada de Salvador-Bahia Professor Antonio Carlos carneiro Barroso email [email protected] HTTP://ensinodematemtica.blogspot.com e HTTP://accbarroso60.wordpress.com...
- Pressão Máxima De Vapor E Vaporização
Por que quando uma pessoa assopra sobre a superfície de um líquido a evaporação aumenta? O sopro retira o vapor que está sobre o líquido, fazendo com que a pressão sobre as moléculas da superfície diminua e, assim, elas passem para o estado...
