Matemática
www.accbarrosogestar.wordpress.comAminas
Classificação: Aminas são compostos derivados do NH3, pela substituição de um, dois, ou três hidrogenios por radicais alquila ou arila. Daí a classificação das aminas em primarias, secundarias e terciárias:
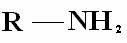

Anima terciária
Outras classificações usuais são animas alifáticas e animas aromáticas. Ou, ainda, monoanimas, diaminas, triaminas, etc. Conforme o numero de grupos aminos, na molécula.
Os nomes das animas são formados com a terminação AMIN. No entanto, são usados nomes especiais, principalmente para aminas aromáticas
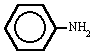
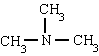

metilamina trimetilamina fenilamina
Em funções mistas, usa-se o prefixo AMINO:
Ácido amino-acético
As metilamina e etalamina são gases. Aminas alifáticas, de 3 a 12 carbonos, são líquidos toxido, com “cheiro de peixe”; os pontos de ebulição não são altos, porque as “pontes de hidrogenios” nas animas são mais fracas do que nos álcoois. Animas com mais de 12 carbonos são sólidos incolores e inodoros.
As animas são usadas em certos tipo de sabões, na vulcanização da borracha e em inúmeras sínteses orgânicas. Em particular, as animas aromáticas são importantíssimas na fabricação de corantes.
Preparação
As animas existem em certos compostos vegetais e são formadas na decomposição de peixes. Primeiro ocorre a aniquilação do amoníaco, em seguida há a redução de vários compostos nitrogenados, isso é importante para obter matéria-prima para a produção de corantes.
Reações
Caráter básico
As aminas são denominadas “bases orgânicas”, pois apresentam caráter básico fraco, idêntico ao do amoníaco. Estes sais são decompostos por bases fortes, pois os “hidróxidos” das animas são instáveis, exatamente como o NH4OH
O caráter básico das animas é devido as par eletrônico livre que existe no nitrogênio, exatamente como no NH3
As animas alifáticas primarias são bases um pouco mais fortes que o amoníaco, pois o grupo alquila “empurra” elétrons para um grupo amino, aumentando a densidade eletrônica no nitrogênio e facilitando a “captura” do H+, para formar o R-NH3+. As aminas alifáticas secundárias, tendo dois grupos de alquilas, são bases mais fortes que as aminas primarias. Seguindo este raciocínio, as animas terciárias deveriam ser ainda mais fortes; no entanto, elas são mais fracas que o próprio NH3; isto se explica porque a existência de três grupos alquilas “ao redor” do nitrogênio deixa “pouco espaço” para a fixação do H+ e a formação do R3NH+; este fenômeno é conhecido , em química orgânica, pelo nome de impedimento entérico ou espacial.
As animas aromáticas são bases fraquíssimas, pois o par eletrônico do nitrogênio “foge” para o anel (fenômeno de ressonância), de modo que o H+ dificilmente poderá protonizá-lo.
Generalizando, podemos dizer que qualquer grupo que “empurra” elétrons para o hidrogênio, ira aumentar a basicidade da anima; caso contrario, a basicidade ira diminuir.
Amidas
Generalidades
Amidas são compostos derivados do NH3 pela substituição de um, dois ou três hidrogênios por radicais acilas.
Ao contrario das animas, não são comuns animas com dois ou três radicais no mesmo nitrogênio. No entanto, são comuns amidas com radical alquila ou arila no nitrogênio estes são compostos “mistos”, em parte amida e em parte amina; a letra N (maiúscula) que aparece no nome indica nitrogênio
São comuns também amidas secundarias cíclicas, denominadas imidas.
Os nomes das amidas derivam dos ácidos correspondentes, trocando-se a terminação ÓICO ou ICO por AMIDA.
A formamida (H – CONH2) é um liquido incolor; as demais são sólidas. As amidas mais simples são solúveis em água devido à polaridade de suas moléculas. Seus pontos de ebulição são altos devido as formação de “pontes de hidrogenios duplas”, como acontece com os ácidos. As amidas são usadas em inúmeras sínteses; a poliamida mais importante é o náilon.
Preparação
Normalmente as amidas não existem na natureza. Elas são preparadas por aquecimento de sais de amônio, por hidratação de nitrilas, ou por amonólise de éster, anidridos e cloretos de ácidos.
Uréia
A uréia é a diamida do acido carbônico
A uréia é um sólido branco, cristalino solúvel em água e constitui um dos produtos finais do metabolismo dos animais, sendo eliminada pela urina.
A uréia é muito importante, pois é largamente usada como adubo, na alimentação do gado, como estabilizador de explosivos e na produção de resinas e medicamentos.
Sendo uma diamina, a uréia tem caráter basico um pouco mais forte que as amidas comuns. A uréia também sofre hidrolise na presença de acido ou bases fortes ou , então, sob a ação da enzima uréase.
Aquecida a seco, a uréia produz o biureto, que é usado como indicador de sais cúpricos, com os quais produz uma cor vermelha muito intensa.
Ésteres
Generalidades
É bom salientar que, alem dos ésteres orgânicos (alifáticos ou aromáticos) existem tambem ésteres inorgânicos, obtidos dos correspondentes ácidos minerais. Nos dois casos, a nomenclatura é semelhante à dos sais
Os ésteres orgânicos de massas moleculares baixas são líquidos incolores e de cheiro agradáveis (usados em essências de frutos); à medida que a massa molecular aumenta, passam a líquidos oleosos (óleos vegetais e animais); ésteres de massa molecular elevada são sólidos(gordura e ceras).
Não possuindo “pontes de hidrogenios”, os ésteres tem pontos de ebulição menores que os dos álcoois e ácidos de igual massa molecular. Pelo mesmo motivo, o ésteres são insolúveis em águas. São, contudo, em solventes orgânicos usuais.
Reações de amonólise e aminólise
Método de obtenção de amidas
R-COO-R1 + NH3 ® R-CO-NH2 + HO-R1
R-COO-R1+ R2-NH2 ® R-CONH-R2 + HO-R1
Aplicações
Essências de frutos - Ésteres de ácidos inferiores e médios com álcoois inferiores e médios.
Exemplo: acetato de octila (essência de laranja).
Óleos e gorduras - Ésteres de glicerol com ácidos graxos.
Ceras - Ésteres de ácidos graxos com álcoois superiores.
Autoria: André Oliveira
- Tipos De Ácidos
Os ácidos se dividem fundamentalmente em orgânicos e inorgânicos ou minerais. Os ácidos orgânicos são compostos que contêm em sua estrutura o grupamento carboxila, composto por um átomo de carbono ligado a um átomo de oxigênio por ligação...
- Álcoois
ÁlcooisLíria Alves Possuem o grupo funcional hidroxilaOs álcoois são compostos orgânicos que possuem o grupo funcional hidroxila (-OH) ligado a um ou mais carbonos saturados. A nomenclatura dos álcoois é realizada trocando-se...
- Ácidos Carboxílicos
Ácidos CarboxílicosAlunos Online Possui a presença do grupo funcional carboxila ligado à cadeia carbônicaÁcidos carboxílicos se caracterizam pela presença do grupo funcional carboxila (- COOH) ligado à cadeia carbônica....
- Aminas
AminasLíria Alves Trimetilamina: encontrada em peixesAminas são compostos orgânicos nitrogenados obtidos através da substituição de hidrogênio da amônia (NH3) por outros grupos orgânicos (radicais alquila ou arila). Elas...
- Classificação Dos ácidos
Classificação dos ácidosLíria Alves Ácidos fortes liberam H+ como maior facilidadeÁcido é toda substância que se ioniza em presença de água e origina íons H+. Como podemos classificar os ácidos? De acordo com vários...
Matemática
Amidas - Aminas e Ésteres
Professor de Matemática e Biologia Antônio Carlos Carneiro Barroso
Colégio Estadual Dinah Gonçalves
email [email protected]
www.ensinodematemtica.blogspot.com.br
www.accbarrosogestar.blogspot.com.br
www.accbarrosogestar.wordpress.comAminas
Classificação: Aminas são compostos derivados do NH3, pela substituição de um, dois, ou três hidrogenios por radicais alquila ou arila. Daí a classificação das aminas em primarias, secundarias e terciárias:
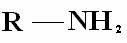

Anima terciária
Outras classificações usuais são animas alifáticas e animas aromáticas. Ou, ainda, monoanimas, diaminas, triaminas, etc. Conforme o numero de grupos aminos, na molécula.
Os nomes das animas são formados com a terminação AMIN. No entanto, são usados nomes especiais, principalmente para aminas aromáticas
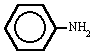
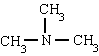

metilamina trimetilamina fenilamina
Em funções mistas, usa-se o prefixo AMINO:
Ácido amino-acético
As metilamina e etalamina são gases. Aminas alifáticas, de 3 a 12 carbonos, são líquidos toxido, com “cheiro de peixe”; os pontos de ebulição não são altos, porque as “pontes de hidrogenios” nas animas são mais fracas do que nos álcoois. Animas com mais de 12 carbonos são sólidos incolores e inodoros.
As animas são usadas em certos tipo de sabões, na vulcanização da borracha e em inúmeras sínteses orgânicas. Em particular, as animas aromáticas são importantíssimas na fabricação de corantes.
Preparação
As animas existem em certos compostos vegetais e são formadas na decomposição de peixes. Primeiro ocorre a aniquilação do amoníaco, em seguida há a redução de vários compostos nitrogenados, isso é importante para obter matéria-prima para a produção de corantes.
Reações
Caráter básico
As aminas são denominadas “bases orgânicas”, pois apresentam caráter básico fraco, idêntico ao do amoníaco. Estes sais são decompostos por bases fortes, pois os “hidróxidos” das animas são instáveis, exatamente como o NH4OH
O caráter básico das animas é devido as par eletrônico livre que existe no nitrogênio, exatamente como no NH3
As animas alifáticas primarias são bases um pouco mais fortes que o amoníaco, pois o grupo alquila “empurra” elétrons para um grupo amino, aumentando a densidade eletrônica no nitrogênio e facilitando a “captura” do H+, para formar o R-NH3+. As aminas alifáticas secundárias, tendo dois grupos de alquilas, são bases mais fortes que as aminas primarias. Seguindo este raciocínio, as animas terciárias deveriam ser ainda mais fortes; no entanto, elas são mais fracas que o próprio NH3; isto se explica porque a existência de três grupos alquilas “ao redor” do nitrogênio deixa “pouco espaço” para a fixação do H+ e a formação do R3NH+; este fenômeno é conhecido , em química orgânica, pelo nome de impedimento entérico ou espacial.
As animas aromáticas são bases fraquíssimas, pois o par eletrônico do nitrogênio “foge” para o anel (fenômeno de ressonância), de modo que o H+ dificilmente poderá protonizá-lo.
Generalizando, podemos dizer que qualquer grupo que “empurra” elétrons para o hidrogênio, ira aumentar a basicidade da anima; caso contrario, a basicidade ira diminuir.
Amidas
Generalidades
Amidas são compostos derivados do NH3 pela substituição de um, dois ou três hidrogênios por radicais acilas.
Ao contrario das animas, não são comuns animas com dois ou três radicais no mesmo nitrogênio. No entanto, são comuns amidas com radical alquila ou arila no nitrogênio estes são compostos “mistos”, em parte amida e em parte amina; a letra N (maiúscula) que aparece no nome indica nitrogênio
São comuns também amidas secundarias cíclicas, denominadas imidas.
Os nomes das amidas derivam dos ácidos correspondentes, trocando-se a terminação ÓICO ou ICO por AMIDA.
A formamida (H – CONH2) é um liquido incolor; as demais são sólidas. As amidas mais simples são solúveis em água devido à polaridade de suas moléculas. Seus pontos de ebulição são altos devido as formação de “pontes de hidrogenios duplas”, como acontece com os ácidos. As amidas são usadas em inúmeras sínteses; a poliamida mais importante é o náilon.
Preparação
Normalmente as amidas não existem na natureza. Elas são preparadas por aquecimento de sais de amônio, por hidratação de nitrilas, ou por amonólise de éster, anidridos e cloretos de ácidos.
Uréia
A uréia é a diamida do acido carbônico
A uréia é um sólido branco, cristalino solúvel em água e constitui um dos produtos finais do metabolismo dos animais, sendo eliminada pela urina.
A uréia é muito importante, pois é largamente usada como adubo, na alimentação do gado, como estabilizador de explosivos e na produção de resinas e medicamentos.
Sendo uma diamina, a uréia tem caráter basico um pouco mais forte que as amidas comuns. A uréia também sofre hidrolise na presença de acido ou bases fortes ou , então, sob a ação da enzima uréase.
Aquecida a seco, a uréia produz o biureto, que é usado como indicador de sais cúpricos, com os quais produz uma cor vermelha muito intensa.
Ésteres
Generalidades
É bom salientar que, alem dos ésteres orgânicos (alifáticos ou aromáticos) existem tambem ésteres inorgânicos, obtidos dos correspondentes ácidos minerais. Nos dois casos, a nomenclatura é semelhante à dos sais
Os ésteres orgânicos de massas moleculares baixas são líquidos incolores e de cheiro agradáveis (usados em essências de frutos); à medida que a massa molecular aumenta, passam a líquidos oleosos (óleos vegetais e animais); ésteres de massa molecular elevada são sólidos(gordura e ceras).
Não possuindo “pontes de hidrogenios”, os ésteres tem pontos de ebulição menores que os dos álcoois e ácidos de igual massa molecular. Pelo mesmo motivo, o ésteres são insolúveis em águas. São, contudo, em solventes orgânicos usuais.
Reações de amonólise e aminólise
Método de obtenção de amidas
R-COO-R1 + NH3 ® R-CO-NH2 + HO-R1
R-COO-R1+ R2-NH2 ® R-CONH-R2 + HO-R1
Aplicações
Essências de frutos - Ésteres de ácidos inferiores e médios com álcoois inferiores e médios.
Exemplo: acetato de octila (essência de laranja).
Óleos e gorduras - Ésteres de glicerol com ácidos graxos.
Ceras - Ésteres de ácidos graxos com álcoois superiores.
Autoria: André Oliveira
- Tipos De Ácidos
Os ácidos se dividem fundamentalmente em orgânicos e inorgânicos ou minerais. Os ácidos orgânicos são compostos que contêm em sua estrutura o grupamento carboxila, composto por um átomo de carbono ligado a um átomo de oxigênio por ligação...
- Álcoois
ÁlcooisLíria Alves Possuem o grupo funcional hidroxilaOs álcoois são compostos orgânicos que possuem o grupo funcional hidroxila (-OH) ligado a um ou mais carbonos saturados. A nomenclatura dos álcoois é realizada trocando-se...
- Ácidos Carboxílicos
Ácidos CarboxílicosAlunos Online Possui a presença do grupo funcional carboxila ligado à cadeia carbônicaÁcidos carboxílicos se caracterizam pela presença do grupo funcional carboxila (- COOH) ligado à cadeia carbônica....
- Aminas
AminasLíria Alves Trimetilamina: encontrada em peixesAminas são compostos orgânicos nitrogenados obtidos através da substituição de hidrogênio da amônia (NH3) por outros grupos orgânicos (radicais alquila ou arila). Elas...
- Classificação Dos ácidos
Classificação dos ácidosLíria Alves Ácidos fortes liberam H+ como maior facilidadeÁcido é toda substância que se ioniza em presença de água e origina íons H+. Como podemos classificar os ácidos? De acordo com vários...
