Matemática
O cálculo estequiométrico, apesar de temido por muitos vestibulandos, deixa de ser um problema se os seguintes passos forem seguidos:
1.° passo – Montar e balancear a equação química.
2.° passo – Escrever a proporção em mols (coeficientes da equação balanceada).
3.° passo – Adaptar a proporção em mols às unidades usadas no enunciado do exercício (massa, volume nas CNTP, n.° de moléculas etc).
4.° passo – Efetuar a regra de três com os dados do exercício.
Equações químicas
As reações que os elementos têm entre si para formar um composto são representadas por equações químicas. Exemplo da reação do hidrogênio com o oxigênio para formar água:

As substâncias no lado esquerdo são chamadas reagentes e, no lado direito, produtos. Os números antes dos símbolos (omitido se for 1) indicam a quantidade de moléculas. Os símbolos entre parênteses indicam o estado físico: (s) sólido, (l) líquido, (g) gasoso e (aq) solução aquosa (muitas substâncias só reagem em solução aquosa). Lembrar que a equação química indica a possibilidade de uma reação. Isto significa que a reação nem sempre ocorrerá com o simples contato físico das substâncias. Algumas precisam de aquecimento, outras,de meio aquoso, outras,de ignição (é o caso do exemplo),etc.
Uma equação química deve ser balanceada, isto é, cada elemento deve ter o mesmo número de átomos em ambos os lados da equação. No exemplo dado, esta condição está satisfeita. O balanceamento significa a necessária igualdade de massas entre os dois lados da equação uma vez que não pode haver perda ou ganho de massa.
Massa atômica, massa molecular
Em química, no lugar das unidades convencionais, a massa de um átomo é expressa em unidades de massa atômica (u) que equivale exatamente a 1/12 da massa do isótopo 12C (carbono 12). Na unidade comum, corresponde a 1,6605402 x 10-27 kg . Pelo fato de o carbono 12 possuir 6 prótons e 6 nêutrons, concluímos que a unidade de massa atômica é, aproximadamente, a massa de um próton ou de um nêutron(1 próton=1,0081u; 1 nêutron=1,0090u). O átomo de 12C foi escolhido como átomo padrão na construção das escalas de massas atômicas. Sua massa atômica foi fixada em 12u.
Unidade de massa atômica (u) é a massa de 1/12 do átomo de 12C.
Massa atômica de um átomo – É a massa desse átomo expressa em u. Indica quantas vezes a massa do átomo é maior que 1/12 da massa de 12C.
Massa atômica de um elemento – A massa atômica de um elemento é a massa média dos átomos desse elemento expressa em u. É igual à média ponderada das massas atômicas dos isótopos constituintes do elemento.
Aplicação
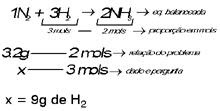
Na reação N2 + H2 NH3, qual é a massa de H2 que reage, quando são obtidos 3 mols de NH3?
Solução:
Fórmula molecular (ou bruta) e fórmula empírica
A fórmula química para um composto obtido por análise de composição sempre é a fórmula empírica. Podemos obter a fórmula molecular da fórmula empírica se nós soubermos a massa molecular do composto. A fórmula molecular sempre será algum múltiplo inteiro da fórmula empírica (isto é, múltiplos inteiros das subscrições da fórmula empírica).
Ex: a Vitamina C (ácido ascórbico) contém 40,92% de C; 4,58% de H e 54,50% de O, em massa. A massa molecular experimentalmente determinada é 176u. Quais são as fórmulas empírica e molecular para o ácido ascórbico?
Em 100 gramas de ácido ascórbico, temos: 40,92 gramas de C; 4,58 gramas de H; 54,50 gramas de O. Isto nos dá os mols de cada elemento:
(40,92g C) x (1mol/12,011g)=3,407moles de C.
(4,58g H) x (1mol/1,008g)=4,544mols de H.
(54,50g O) x (1mol/15,999g)=3,406mols de O.
Determina-se a relação com menor número inteiro, dividindo-se cada valor pelo de menor quantidade de mols (3.406 moles do Oxigênio):

A quantidade relativa de mols de carbono e oxigênio parece ser igual, mas a quantia relativa de hidrogênio é mais alta. Considerando que não podemos ter “átomos fracionários” em um composto, nós precisamos normalizar a quantia relativa de hidrogênio para ser igual a um inteiro. 1.333 é 1 + 1/3, assim se multiplicarmos as quantias relativas de cada átomo por ‘3’, deveremos obter valores inteiros para cada átomo.
C = (1.0) x 3 = 3
H = (1.333) x 3 = 4
O = (1.0) x 3 = 3
ou, C3H4O3
Esta é a fórmula empírica para o ácido ascórbico. E a fórmula molecular? Falamos que, experimentalmente, foi determinada uma massa molecular de 176u.Qual é a massa molecular dafórmula empírica?
(3 x 12,011) + (4 x 1,008) + (3 x 15,999) = 88,062u.
A massa molecular da fórmula empírica é menor que a experimentalmente determinada. Qual é a relação entre os dois valores?
(176u /88,062u) = 2,0
Se multiplicarmos a fórmula empírica por ‘2’, então a massa molecular estará correta. Assim, a fórmula molecular é:
2 x C3H4O3 = C6H8O6
extraido de www.colaweb.com.br
- Cálculo Estequiométrico Equação Química, Reação E Reagentes
Professor de Matemática e Biologia Antônio Carlos Carneiro BarrosoColégio Estadual Dinah Gonçalvesemail [email protected] www.ensinodematemtica.blogspot.com.brwww.accbarrosogestar.blogspot.com.br WWW.profantoniocarneiro.com ...
- Substâncias
Uma das maiores confusões que as pessoas fazem na hora de classificar as substâncias reside nos quesitos de substância simples e substância pura. Para que isso fique claro é fundamental que entendamos bem algumas coisas antes de chegarmos a essa...
- CÁlculo EstequiomÉtrico
Cálculo estequiométrico Equação química, reação e reagentes O cálculo estequiométrico, ou cálculo das medidas apropriadas, é um dos maiores passos dados pela humanidade no campo científico e é o cerne da química quantitativa. Lavoisier...
- Massa Atômica Qual A Unidade De Medida Dessa Grandeza Tão Pequena
Professor de Matemática e Biologia Antônio Carlos Carneiro BarrosoColégio Estadual Dinah Gonçalvesemail [email protected] www.ensinodematemtica.blogspot.com.brwww.accbarrosogestar.blogspot.com.br WWW.profantoniocarneiro.com ...
- Átomos
Há muito tempo, cerca de 30 anos antes de Cristo, o filósofo grego Demócrito já afirmava que a matéria era formada por partículas muito pequenas, às quais ele chamou de átomos. Entretanto o conceito de átomo desse filósofo é bem diferente do...
Matemática
Cálculo estequiométrico
O cálculo estequiométrico, apesar de temido por muitos vestibulandos, deixa de ser um problema se os seguintes passos forem seguidos:
1.° passo – Montar e balancear a equação química.
2.° passo – Escrever a proporção em mols (coeficientes da equação balanceada).
3.° passo – Adaptar a proporção em mols às unidades usadas no enunciado do exercício (massa, volume nas CNTP, n.° de moléculas etc).
4.° passo – Efetuar a regra de três com os dados do exercício.
Equações químicas
As reações que os elementos têm entre si para formar um composto são representadas por equações químicas. Exemplo da reação do hidrogênio com o oxigênio para formar água:

As substâncias no lado esquerdo são chamadas reagentes e, no lado direito, produtos. Os números antes dos símbolos (omitido se for 1) indicam a quantidade de moléculas. Os símbolos entre parênteses indicam o estado físico: (s) sólido, (l) líquido, (g) gasoso e (aq) solução aquosa (muitas substâncias só reagem em solução aquosa). Lembrar que a equação química indica a possibilidade de uma reação. Isto significa que a reação nem sempre ocorrerá com o simples contato físico das substâncias. Algumas precisam de aquecimento, outras,de meio aquoso, outras,de ignição (é o caso do exemplo),etc.
Uma equação química deve ser balanceada, isto é, cada elemento deve ter o mesmo número de átomos em ambos os lados da equação. No exemplo dado, esta condição está satisfeita. O balanceamento significa a necessária igualdade de massas entre os dois lados da equação uma vez que não pode haver perda ou ganho de massa.
Massa atômica, massa molecular
Em química, no lugar das unidades convencionais, a massa de um átomo é expressa em unidades de massa atômica (u) que equivale exatamente a 1/12 da massa do isótopo 12C (carbono 12). Na unidade comum, corresponde a 1,6605402 x 10-27 kg . Pelo fato de o carbono 12 possuir 6 prótons e 6 nêutrons, concluímos que a unidade de massa atômica é, aproximadamente, a massa de um próton ou de um nêutron(1 próton=1,0081u; 1 nêutron=1,0090u). O átomo de 12C foi escolhido como átomo padrão na construção das escalas de massas atômicas. Sua massa atômica foi fixada em 12u.
Unidade de massa atômica (u) é a massa de 1/12 do átomo de 12C.
Massa atômica de um átomo – É a massa desse átomo expressa em u. Indica quantas vezes a massa do átomo é maior que 1/12 da massa de 12C.
Massa atômica de um elemento – A massa atômica de um elemento é a massa média dos átomos desse elemento expressa em u. É igual à média ponderada das massas atômicas dos isótopos constituintes do elemento.
Aplicação
Na reação N2 + H2 NH3, qual é a massa de H2 que reage, quando são obtidos 3 mols de NH3?
Solução:

Fórmula molecular (ou bruta) e fórmula empírica
A fórmula química para um composto obtido por análise de composição sempre é a fórmula empírica. Podemos obter a fórmula molecular da fórmula empírica se nós soubermos a massa molecular do composto. A fórmula molecular sempre será algum múltiplo inteiro da fórmula empírica (isto é, múltiplos inteiros das subscrições da fórmula empírica).
Ex: a Vitamina C (ácido ascórbico) contém 40,92% de C; 4,58% de H e 54,50% de O, em massa. A massa molecular experimentalmente determinada é 176u. Quais são as fórmulas empírica e molecular para o ácido ascórbico?
Em 100 gramas de ácido ascórbico, temos: 40,92 gramas de C; 4,58 gramas de H; 54,50 gramas de O. Isto nos dá os mols de cada elemento:
(40,92g C) x (1mol/12,011g)=3,407moles de C.
(4,58g H) x (1mol/1,008g)=4,544mols de H.
(54,50g O) x (1mol/15,999g)=3,406mols de O.
Determina-se a relação com menor número inteiro, dividindo-se cada valor pelo de menor quantidade de mols (3.406 moles do Oxigênio):

A quantidade relativa de mols de carbono e oxigênio parece ser igual, mas a quantia relativa de hidrogênio é mais alta. Considerando que não podemos ter “átomos fracionários” em um composto, nós precisamos normalizar a quantia relativa de hidrogênio para ser igual a um inteiro. 1.333 é 1 + 1/3, assim se multiplicarmos as quantias relativas de cada átomo por ‘3’, deveremos obter valores inteiros para cada átomo.
C = (1.0) x 3 = 3
H = (1.333) x 3 = 4
O = (1.0) x 3 = 3
ou, C3H4O3
Esta é a fórmula empírica para o ácido ascórbico. E a fórmula molecular? Falamos que, experimentalmente, foi determinada uma massa molecular de 176u.Qual é a massa molecular dafórmula empírica?
(3 x 12,011) + (4 x 1,008) + (3 x 15,999) = 88,062u.
A massa molecular da fórmula empírica é menor que a experimentalmente determinada. Qual é a relação entre os dois valores?
(176u /88,062u) = 2,0
Se multiplicarmos a fórmula empírica por ‘2’, então a massa molecular estará correta. Assim, a fórmula molecular é:
2 x C3H4O3 = C6H8O6
extraido de www.colaweb.com.br
- Cálculo Estequiométrico Equação Química, Reação E Reagentes
Professor de Matemática e Biologia Antônio Carlos Carneiro BarrosoColégio Estadual Dinah Gonçalvesemail [email protected] www.ensinodematemtica.blogspot.com.brwww.accbarrosogestar.blogspot.com.br WWW.profantoniocarneiro.com ...
- Substâncias
Uma das maiores confusões que as pessoas fazem na hora de classificar as substâncias reside nos quesitos de substância simples e substância pura. Para que isso fique claro é fundamental que entendamos bem algumas coisas antes de chegarmos a essa...
- CÁlculo EstequiomÉtrico
Cálculo estequiométrico Equação química, reação e reagentes O cálculo estequiométrico, ou cálculo das medidas apropriadas, é um dos maiores passos dados pela humanidade no campo científico e é o cerne da química quantitativa. Lavoisier...
- Massa Atômica Qual A Unidade De Medida Dessa Grandeza Tão Pequena
Professor de Matemática e Biologia Antônio Carlos Carneiro BarrosoColégio Estadual Dinah Gonçalvesemail [email protected] www.ensinodematemtica.blogspot.com.brwww.accbarrosogestar.blogspot.com.br WWW.profantoniocarneiro.com ...
- Átomos
Há muito tempo, cerca de 30 anos antes de Cristo, o filósofo grego Demócrito já afirmava que a matéria era formada por partículas muito pequenas, às quais ele chamou de átomos. Entretanto o conceito de átomo desse filósofo é bem diferente do...
