Matemática
Alguma vez você já encontrou algo sem identificação em sua geladeira ou armário da cozinha e ficou se perguntando o que seria aquilo? Nesse caso, provavelmente, você observou algumas propriedades até chegar a alguma conclusão. Por exemplo: um pote de vidro contendo uma substância branca, em pó, que você sacode e percebe que o pó é fino. Certamente você já se lembrou de açúcar ou sal.
Na química, nos valemos de certas propriedades das substâncias para identificá-las. Algumas propriedades, por mais simples que pareçam, podem excluir inúmeras possibilidades, embora não possam ser determinantes.
Propriedades e identidade das substâncias
Imagine que lhe entreguem um pequeno cilindro. Observando-o, você nota sua aparência metálica e cor prateada. Você não pode dizer com certeza de que se trata, mas pode excluir uma série de substâncias. Já sabe que o cilindro não pode ser de gelo, papel ou madeira (não são metálicos), ouro e cobre também não (não são prateados). Notou como dá para excluir uma infinidade de coisas?
Continuemos com o mesmo cilindro. Estamos em dúvida entre alumínio, prata, aço, níquel, entre outros. Podemos fazer o seguinte: obtendo a massa do cilindro com o auxílio de uma balança, e conseguindo seu volume, podemos determinar sua densidade. Essa propriedade já é bem mais específica. Consultamos uma tabela de densidade e podemos eventualmente chegar a uma resposta conclusiva. Quando o valor da densidade não é suficiente, podemos, por exemplo, aferir os pontos de fusão e de ebulição para melhorarmos a identificação.
Curva de aquecimento
Um levantamento de dados muito útil na química é a chamada curva de aquecimento. Pega-se uma amostra no estado sólido a uma determinada temperatura e submete-se a mesma a um aquecimento constante. A amostra sólida vai aquecendo até que começa a fundir. Transformada em líquido continua aquecendo até entrar em ebulição. Mesmo depois de transformada em gás, pode continuar sendo aquecida. Tomando nota das temperaturas de tempos em tempos, podemos construir o seguinte gráfico:
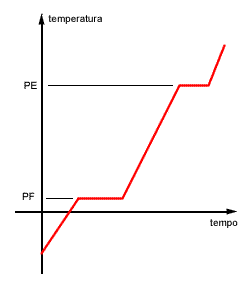
É importante notarmos dois patamares de temperatura: um corresponde ao ponto de fusão e o outro ao de ebulição. Lembre-se de que durante o processo de solidificação ou liquefação, assim como no de condensação ou vaporização, a temperatura permanece constante.
Outra coisa a ser lembrada: em temperaturas inferiores ao ponto de fusão a amostra é sólida; em temperatura entre o ponto de fusão e o de ebulição é líquida; em temperaturas acima do ponto de ebulição a amostra á gasosa. Exatamente no ponto de fusão coexistem as fases sólida e líquida e, exatamente no ponto de ebulição coexistem as fases líquida e gasosa.
Perceba que, se eu pedir a você um copo com água exatamente a 0oC e você não dispuser de um termômetro, pode fazer o seguinte: coloque bastante gelo em um copo e complete com água. Após alguns instantes (para que o equilíbrio térmico seja atingido) se existir ao mesmo tempo água líquida e gelo, você saberá que a temperatura é exatamente o ponto de fusão, ou seja, 0°C!
Misturas
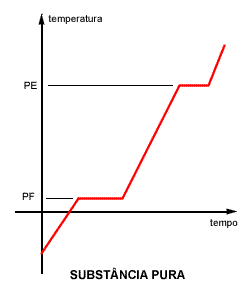
O levantamento da curva de aquecimento também nos dá outra informação importante. Ela nos diz se nossa amostra é uma substância pura ou uma mistura. Como? Pela análise dos patamares que se formam no PF (ponto de fusão) e PE (ponto de ebulição).
Se ambos - PF e PE - apresentarem temperatura constante, como no gráfico anterior, podemos afirmar que a amostra é uma substância pura. Se um deles ou os dois apresentarem variação, trata-se de uma mistura.
Página 3
Classificando as misturas
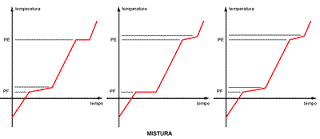
Uma vez identificada que a amostra é uma mistura, analisando a curva de aquecimento podemos ainda classificá-la como simples, eutética ou azeotrópica. Quando a mistura apresenta variação nos dois patamares, PF e PE, a mistura é simples. Quando a variação é em apenas um patamar, ou seja, apenas o PE ou o PF variam, a classificação é a seguinte:
# PF constante - mistura eutética;
# PE constante - mistura azeotrópica.
O exemplo mais comum de mistura eutética é a solda utilizada em eletrônica (37% chumbo e 63% estanho) e o de mistura azeotrópica é a mistura água e álcool (4% água e 96% álcool - álcool 96 GL).
Como você viu, propriedades simples, como aspecto e cor, e uma simples curva de aquecimento podem ser muito úteis na identificação de uma substância.
*Fábio Rendelucci é professor de química e física, diretor do cursinho COC-Universitário de Santos e presidente da ONG Sobreviventes.
- Compostos Orgânicos: Características Gerais
Líria Alves A cetona é um composto orgânicoOs compostos orgânicos em sua maioria são formados pela ligação entre átomos de carbono e hidrogênio. Sendo assim, a atração entre elétrons das moléculas orgânicas é praticamente...
- Calor E MudanÇa De Estado
1. CALOR E MUDANÇA DE ESTADO Toda matéria, dependendo da temperatura, pode se apresentar em três estados: sólido, líquido e gasoso. As possíveis mudanças de estado, quando uma substância recebe ou cede calor, estão esquematizadas na figura abaixo:...
- Propriedades Organolépticas Identificação Pelos Nossos Sentidos
Características de uma substância que podem ser percebidas com nossos sentidos são chamadas de propriedades organolépticas. Identificar substâncias é uma das atividades realizadas pela química analítica. Muitas vezes nos deparamos com situações...
- Separação De Misturas
Professor de Matemática e Biologia Antônio Carlos Carneiro BarrosoColégio Estadual Dinah Gonçalvesemail [email protected] www.ensinodematemtica.blogspot.com.brwww.accbarrosogestar.blogspot.com.br WWW.profantoniocarneiro.com ...
- Mudanças De Estado Físico -b Fusão, Solidificação, Vaporização, Sublimação E Condensação
É provável que nas suas aulas de ciências no ensino fundamental você tenha aprendido três estados físicos da matéria, o sólido, o líquido e o gasoso. Esses estados físicos vêm do estado de agregação das moléculas constituintes da matéria....
Matemática
Curva de aquecimento Identificando substâncias pelos tipos de mistura
Alguma vez você já encontrou algo sem identificação em sua geladeira ou armário da cozinha e ficou se perguntando o que seria aquilo? Nesse caso, provavelmente, você observou algumas propriedades até chegar a alguma conclusão. Por exemplo: um pote de vidro contendo uma substância branca, em pó, que você sacode e percebe que o pó é fino. Certamente você já se lembrou de açúcar ou sal.
Na química, nos valemos de certas propriedades das substâncias para identificá-las. Algumas propriedades, por mais simples que pareçam, podem excluir inúmeras possibilidades, embora não possam ser determinantes.
Propriedades e identidade das substâncias
Imagine que lhe entreguem um pequeno cilindro. Observando-o, você nota sua aparência metálica e cor prateada. Você não pode dizer com certeza de que se trata, mas pode excluir uma série de substâncias. Já sabe que o cilindro não pode ser de gelo, papel ou madeira (não são metálicos), ouro e cobre também não (não são prateados). Notou como dá para excluir uma infinidade de coisas?
Continuemos com o mesmo cilindro. Estamos em dúvida entre alumínio, prata, aço, níquel, entre outros. Podemos fazer o seguinte: obtendo a massa do cilindro com o auxílio de uma balança, e conseguindo seu volume, podemos determinar sua densidade. Essa propriedade já é bem mais específica. Consultamos uma tabela de densidade e podemos eventualmente chegar a uma resposta conclusiva. Quando o valor da densidade não é suficiente, podemos, por exemplo, aferir os pontos de fusão e de ebulição para melhorarmos a identificação.
Curva de aquecimento
Um levantamento de dados muito útil na química é a chamada curva de aquecimento. Pega-se uma amostra no estado sólido a uma determinada temperatura e submete-se a mesma a um aquecimento constante. A amostra sólida vai aquecendo até que começa a fundir. Transformada em líquido continua aquecendo até entrar em ebulição. Mesmo depois de transformada em gás, pode continuar sendo aquecida. Tomando nota das temperaturas de tempos em tempos, podemos construir o seguinte gráfico:

É importante notarmos dois patamares de temperatura: um corresponde ao ponto de fusão e o outro ao de ebulição. Lembre-se de que durante o processo de solidificação ou liquefação, assim como no de condensação ou vaporização, a temperatura permanece constante.
Outra coisa a ser lembrada: em temperaturas inferiores ao ponto de fusão a amostra é sólida; em temperatura entre o ponto de fusão e o de ebulição é líquida; em temperaturas acima do ponto de ebulição a amostra á gasosa. Exatamente no ponto de fusão coexistem as fases sólida e líquida e, exatamente no ponto de ebulição coexistem as fases líquida e gasosa.
Perceba que, se eu pedir a você um copo com água exatamente a 0oC e você não dispuser de um termômetro, pode fazer o seguinte: coloque bastante gelo em um copo e complete com água. Após alguns instantes (para que o equilíbrio térmico seja atingido) se existir ao mesmo tempo água líquida e gelo, você saberá que a temperatura é exatamente o ponto de fusão, ou seja, 0°C!
Misturas
O levantamento da curva de aquecimento também nos dá outra informação importante. Ela nos diz se nossa amostra é uma substância pura ou uma mistura. Como? Pela análise dos patamares que se formam no PF (ponto de fusão) e PE (ponto de ebulição).
Se ambos - PF e PE - apresentarem temperatura constante, como no gráfico anterior, podemos afirmar que a amostra é uma substância pura. Se um deles ou os dois apresentarem variação, trata-se de uma mistura.


Página 3
Classificando as misturas
Uma vez identificada que a amostra é uma mistura, analisando a curva de aquecimento podemos ainda classificá-la como simples, eutética ou azeotrópica. Quando a mistura apresenta variação nos dois patamares, PF e PE, a mistura é simples. Quando a variação é em apenas um patamar, ou seja, apenas o PE ou o PF variam, a classificação é a seguinte:
# PF constante - mistura eutética;
# PE constante - mistura azeotrópica.
O exemplo mais comum de mistura eutética é a solda utilizada em eletrônica (37% chumbo e 63% estanho) e o de mistura azeotrópica é a mistura água e álcool (4% água e 96% álcool - álcool 96 GL).
Como você viu, propriedades simples, como aspecto e cor, e uma simples curva de aquecimento podem ser muito úteis na identificação de uma substância.
*Fábio Rendelucci é professor de química e física, diretor do cursinho COC-Universitário de Santos e presidente da ONG Sobreviventes.
- Compostos Orgânicos: Características Gerais
Líria Alves A cetona é um composto orgânicoOs compostos orgânicos em sua maioria são formados pela ligação entre átomos de carbono e hidrogênio. Sendo assim, a atração entre elétrons das moléculas orgânicas é praticamente...
- Calor E MudanÇa De Estado
1. CALOR E MUDANÇA DE ESTADO Toda matéria, dependendo da temperatura, pode se apresentar em três estados: sólido, líquido e gasoso. As possíveis mudanças de estado, quando uma substância recebe ou cede calor, estão esquematizadas na figura abaixo:...
- Propriedades Organolépticas Identificação Pelos Nossos Sentidos
Características de uma substância que podem ser percebidas com nossos sentidos são chamadas de propriedades organolépticas. Identificar substâncias é uma das atividades realizadas pela química analítica. Muitas vezes nos deparamos com situações...
- Separação De Misturas
Professor de Matemática e Biologia Antônio Carlos Carneiro BarrosoColégio Estadual Dinah Gonçalvesemail [email protected] www.ensinodematemtica.blogspot.com.brwww.accbarrosogestar.blogspot.com.br WWW.profantoniocarneiro.com ...
- Mudanças De Estado Físico -b Fusão, Solidificação, Vaporização, Sublimação E Condensação
É provável que nas suas aulas de ciências no ensino fundamental você tenha aprendido três estados físicos da matéria, o sólido, o líquido e o gasoso. Esses estados físicos vêm do estado de agregação das moléculas constituintes da matéria....
