Matemática
Densidade, concentração e molaridade são três conceitos básicos e causam, às vezes, grande confusão. Antes de falarmos nos três, vamos dar certo destaque a um deles: a densidade, que é uma propriedade intrínseca da matéria. Lembre-se que a matéria tem duas características fundamentais: possui massa e ocupa lugar no espaço. Lembre-se que "ocupar lugar no espaço" é sinônimo de dizermos "tem volume". Assim, massa e volume são coisas que tudo que é material tem.
A relação entre a massa e o volume de um corpo qualquer recebe o nome de densidade, que pode ser matematicamente expressa como:
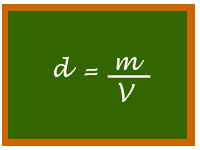
Perceba que tudo que é material possui densidade, não importando se é uma substância simples ou uma mistura, independentemente de seu estado físico. Uma gota de água pura, uma gota de água salgada ou mesmo o vapor da água ou um cubo de gelo possuem densidade, embora em cada uma das situações exemplificadas o valor dessa densidade varie.
Densidade e concentração
Quando falamos em concentração estamos nos referindo obrigatoriamente a uma solução. Uma solução tem pelo menos dois componentes: soluto e solvente. Soluto é aquele que está dissolvido, solvente aquele que dissolve. Em um copo de água com sal teremos a água como solvente e o sal como soluto. Essa solução possui densidade? Claro que sim, afinal é matéria! Só que as soluções apresentam também outra característica muito importante: a concentração.
O conceito concentração é amplamente utilizado em nosso cotidiano. Cansamos de ler rótulos de produtos tais como "suco concentrado" ou "detergente concentrado", e ainda ouvimos muito falar em concentração disso ou daquilo. A concentração nada mais é do que a relação entre a massa do soluto (o que está dissolvido) e do volume da solução. Quer ver como é simples?
A concentração e cafezinho
Você vem me visitar e eu lhe ofereço um café. Pergunto a você: quantas colheres de açúcar (ou quantas gotas de adoçante)? O que eu quero saber, quimicamente falando, é se você quer uma solução de café (solvente) com açúcar (soluto) muito ou pouco concentrada. Se você é um "formigão", provavelmente gostará de seu café bem doce, ou seja, com bastante quantidade (massa) de açúcar por xícara (volume) de café. Se estiver de dieta me pedirá um café com baixa concentração de açúcar, ou seja, pouca quantidade (massa) de açúcar por xícara (volume) de café. Podemos então calcular a concentração de uma solução se soubermos duas coisas: a massa do soluto e o volume da solução.
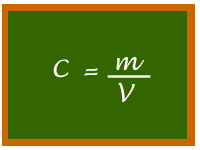
A concentração altera a densidade? Altera. Vamos pensar com um pouco de cuidado.
Pegue uma xícara de café (sem açúcar) com, por exemplo, 100mL de café. Se você aferir e obtiver, digamos, 100g (sua massa), poderá calcular sua densidade: d = m/V = 1g/mL. Coloque nessa xícara uma colher com mais ou menos 10g de açúcar. A nova massa será de 100 + 10=110g, e a nova densidade d = m/V = 1,1g/mL.
Vamos nos ater agora à concentração. Antes de colocarmos o açúcar, a concentração de açúcar no café era de zero, afinal não tinha nenhum açúcar. Depois de adoçado, a concentração passa a ser de C = m/V = 0,1g/mL.
Fica claro que quanto mais açúcar colocarmos, maior a densidade e maior a concentração.
Molaridade e concentração molar
Lembre-se de que para a química as quantidades são, muito costumeiramente, expressas em mols ou moles (plural de mol). Podemos então calcular algo que chamaremos de concentração molar. Concentração porque relaciona a quantidade de soluto por volume e molar porque essa quantidade não será expressa em quantidade de massa, mas sim em moles. Supondo ainda o exemplo da xícara de café, e supondo que o açúcar utilizado tenha a fórmula C6H12O6, podemos calcular quantos moles as 10g de açúcar representam e calcular qual a concentração molar ou molaridade dessa solução.
A molaridade nada mais é então que a relação entre a quantidade de soluto expressa em moles e o volume da solução.
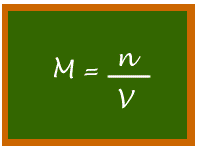
Relembrando e tomando cuidado...
Solvente: aquele que "dissolve";
Soluto: aquele que é "dissolvido";
* Densidade: relação entre a massa e o volume de qualquer corpo material;
* Concentração: relação entre a massa do soluto e o volume da solução;
* Molaridade: relação entre o número de mol do soluto e o volume da solução.
Cuidado: Matematicamente, densidade e concentração têm fórmulas semelhantes - d=m/V e C=m/V, mas não são a mesma coisa: o m na fórmula da densidade é a massa total da amostra enquanto que na concentração é a massa apenas do soluto.
* Fábio Rendelucci é professor de química e física e diretor do cursinho COC-Universitário de Santos (SP).
- Hidrostática
Hidrostática é a parte da física que estuda as forças exercidas por e sobre fluidos que estão em repouso. Conceito de pressão: A grandeza dada pela relação entre a intensidade da força que atua perpendicularmente e a área em que ela se distribui...
- Lei De Avogadro
Do número de Avogadro, sabemos que há aproximadamente 6,02 x 1023 átomos/mol. Então, em 0,0142 mol temos : (0,0142 mol) x (6,02 x 1023 átomos/mol) = 8,55 x 1021átomos Volume molar de um gás CNTP: temperatura = 0 °C e pressão =1atm. É o volume...
- Soluções Soluto, Solvente, Concentração E Curva De Solubilidade
Aproximadamente 90% das reações químicas acontecem com os reagentes dissolvidos em algum líquido. Muitas das coisas que consumimos também são soluções. Daí a importância de entendermos algumas coisas sobre soluções. Uma solução é sempre...
- Difusão Facilitada
Professor de Matemática e Biologia Antônio Carlos Carneiro BarrosoColégio Estadual Dinah Gonçalvesemail [email protected] www.ensinodematemtica.blogspot.com.brwww.accbarrosogestar.blogspot.com.br WWW.profantoniocarneiro.com...
- Soluções Aquosas Estudo Qualitativo E Quantitativo Das Concentrações
Professor de Matemática e Biologia Antônio Carlos Carneiro BarrosoColégio Estadual Dinah Gonçalvesemail [email protected] www.ensinodematemtica.blogspot.com.brwww.accbarrosogestar.blogspot.com.br WWW.profantoniocarneiro.com ...
Matemática
Densidade, concentração e molaridade Três conceitos básicos
Professor de Matemática e Biologia Antônio Carlos Carneiro Barroso
Colégio Estadual Dinah Gonçalves
email [email protected]
www.ensinodematemtica.blogspot.com.br
www.accbarrosogestar.blogspot.com.br
WWW.profantoniocarneiro.com
Densidade, concentração e molaridade são três conceitos básicos e causam, às vezes, grande confusão. Antes de falarmos nos três, vamos dar certo destaque a um deles: a densidade, que é uma propriedade intrínseca da matéria. Lembre-se que a matéria tem duas características fundamentais: possui massa e ocupa lugar no espaço. Lembre-se que "ocupar lugar no espaço" é sinônimo de dizermos "tem volume". Assim, massa e volume são coisas que tudo que é material tem.
A relação entre a massa e o volume de um corpo qualquer recebe o nome de densidade, que pode ser matematicamente expressa como:
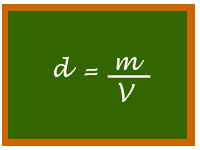
Perceba que tudo que é material possui densidade, não importando se é uma substância simples ou uma mistura, independentemente de seu estado físico. Uma gota de água pura, uma gota de água salgada ou mesmo o vapor da água ou um cubo de gelo possuem densidade, embora em cada uma das situações exemplificadas o valor dessa densidade varie.
Densidade e concentração
Quando falamos em concentração estamos nos referindo obrigatoriamente a uma solução. Uma solução tem pelo menos dois componentes: soluto e solvente. Soluto é aquele que está dissolvido, solvente aquele que dissolve. Em um copo de água com sal teremos a água como solvente e o sal como soluto. Essa solução possui densidade? Claro que sim, afinal é matéria! Só que as soluções apresentam também outra característica muito importante: a concentração.
O conceito concentração é amplamente utilizado em nosso cotidiano. Cansamos de ler rótulos de produtos tais como "suco concentrado" ou "detergente concentrado", e ainda ouvimos muito falar em concentração disso ou daquilo. A concentração nada mais é do que a relação entre a massa do soluto (o que está dissolvido) e do volume da solução. Quer ver como é simples?
A concentração e cafezinho
Você vem me visitar e eu lhe ofereço um café. Pergunto a você: quantas colheres de açúcar (ou quantas gotas de adoçante)? O que eu quero saber, quimicamente falando, é se você quer uma solução de café (solvente) com açúcar (soluto) muito ou pouco concentrada. Se você é um "formigão", provavelmente gostará de seu café bem doce, ou seja, com bastante quantidade (massa) de açúcar por xícara (volume) de café. Se estiver de dieta me pedirá um café com baixa concentração de açúcar, ou seja, pouca quantidade (massa) de açúcar por xícara (volume) de café. Podemos então calcular a concentração de uma solução se soubermos duas coisas: a massa do soluto e o volume da solução.
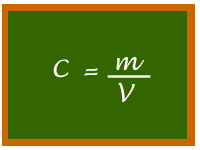
A concentração altera a densidade? Altera. Vamos pensar com um pouco de cuidado.
Pegue uma xícara de café (sem açúcar) com, por exemplo, 100mL de café. Se você aferir e obtiver, digamos, 100g (sua massa), poderá calcular sua densidade: d = m/V = 1g/mL. Coloque nessa xícara uma colher com mais ou menos 10g de açúcar. A nova massa será de 100 + 10=110g, e a nova densidade d = m/V = 1,1g/mL.
Vamos nos ater agora à concentração. Antes de colocarmos o açúcar, a concentração de açúcar no café era de zero, afinal não tinha nenhum açúcar. Depois de adoçado, a concentração passa a ser de C = m/V = 0,1g/mL.
Fica claro que quanto mais açúcar colocarmos, maior a densidade e maior a concentração.
Molaridade e concentração molar
Lembre-se de que para a química as quantidades são, muito costumeiramente, expressas em mols ou moles (plural de mol). Podemos então calcular algo que chamaremos de concentração molar. Concentração porque relaciona a quantidade de soluto por volume e molar porque essa quantidade não será expressa em quantidade de massa, mas sim em moles. Supondo ainda o exemplo da xícara de café, e supondo que o açúcar utilizado tenha a fórmula C6H12O6, podemos calcular quantos moles as 10g de açúcar representam e calcular qual a concentração molar ou molaridade dessa solução.
A molaridade nada mais é então que a relação entre a quantidade de soluto expressa em moles e o volume da solução.
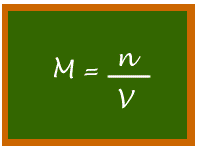
Relembrando e tomando cuidado...
Solvente: aquele que "dissolve";
Soluto: aquele que é "dissolvido";
* Densidade: relação entre a massa e o volume de qualquer corpo material;
* Concentração: relação entre a massa do soluto e o volume da solução;
* Molaridade: relação entre o número de mol do soluto e o volume da solução.
Cuidado: Matematicamente, densidade e concentração têm fórmulas semelhantes - d=m/V e C=m/V, mas não são a mesma coisa: o m na fórmula da densidade é a massa total da amostra enquanto que na concentração é a massa apenas do soluto.
* Fábio Rendelucci é professor de química e física e diretor do cursinho COC-Universitário de Santos (SP).
- Hidrostática
Hidrostática é a parte da física que estuda as forças exercidas por e sobre fluidos que estão em repouso. Conceito de pressão: A grandeza dada pela relação entre a intensidade da força que atua perpendicularmente e a área em que ela se distribui...
- Lei De Avogadro
Do número de Avogadro, sabemos que há aproximadamente 6,02 x 1023 átomos/mol. Então, em 0,0142 mol temos : (0,0142 mol) x (6,02 x 1023 átomos/mol) = 8,55 x 1021átomos Volume molar de um gás CNTP: temperatura = 0 °C e pressão =1atm. É o volume...
- Soluções Soluto, Solvente, Concentração E Curva De Solubilidade
Aproximadamente 90% das reações químicas acontecem com os reagentes dissolvidos em algum líquido. Muitas das coisas que consumimos também são soluções. Daí a importância de entendermos algumas coisas sobre soluções. Uma solução é sempre...
- Difusão Facilitada
Professor de Matemática e Biologia Antônio Carlos Carneiro BarrosoColégio Estadual Dinah Gonçalvesemail [email protected] www.ensinodematemtica.blogspot.com.brwww.accbarrosogestar.blogspot.com.br WWW.profantoniocarneiro.com...
- Soluções Aquosas Estudo Qualitativo E Quantitativo Das Concentrações
Professor de Matemática e Biologia Antônio Carlos Carneiro BarrosoColégio Estadual Dinah Gonçalvesemail [email protected] www.ensinodematemtica.blogspot.com.brwww.accbarrosogestar.blogspot.com.br WWW.profantoniocarneiro.com ...
