Matemática
Cada vez mais percebemos como a linguagem da química orgânica está fazendo parte do cotidiano das pessoas. Por exemplo, atualmente, qualquer pessoa que vai ao supermercado procura comprar alimentos sem gordura trans. Agora, o que é essa tal gordura trans?
Para responder, precisamos fazer uma viagem através da química orgânica.
Os químicos orgânicos dispõem de diversas técnicas de determinação da estrutura molecular. No caso do termo "trans", ele corresponde a um conjunto de moléculas cujas fórmulas empíricas são iguais. Quando isso acontece, tem-se a chamada isomeria. Então, vamos entender um pouco sobre esse tema.
Isômeros de constituição
Por exemplo, a fórmula molecular C2H6O: ela corresponde a duas substâncias conhecidas, o etanol e o metóxi-metano (éter dimetílico). Podemos distinguir essas duas substâncias com base nas suas propriedades físicas - seus pontos de fusão e ebulição (p.e.), índice de refração, etc. O etanol é um líquido (p.e. 78,5oC), muito usado como solvente nos laboratórios e na indústria, presente também nas bebidas alcoólicas. O éter dimetílico é um gás (p.e. - 23oC) usado como gás refrigerante, que substitui os Freons.
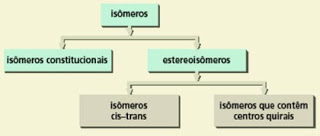
Moléculas como essas, cujas fórmulas moleculares são as mesmas, porém com as sequências dos átomos ligados diferentes, são chamadas de isômeros constitucionais ou de constituição.
Fórmula molecular: C2H6O
Etanol: CH3CH2OH
Éter dimetílico: CH3OCH3
Duas substâncias que ocorrem na natureza ilustram as consequências biológicas dessas diferenças estruturais. A prostaciclina I2 impede que o sangue coagule no sistema circulatório. A tromboxana A2, excretada quando ocorre um ferimento, induz à agregação plaquetária e à formação de coágulos sobre a ferida. Esses compostos também são isômeros constitucionais (têm a fórmula molecular C20H32O5) e sua conectividade não é muito diferente, tanto que são sintetizados no organismo a partir do mesmo material.
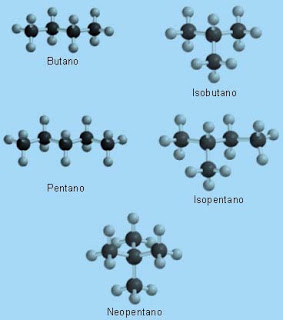
A classe dos alcanos comporta um grande e variado número de isômeros constitucionais, à medida que o número de átomos de carbonos aumenta. Por exemplo, butano e isobutano são isômeros constitucionais com a fórmula molecular de C4H10. Já a fórmula C5H12 possui três isômeros (pentano, isopentano e neopentano):
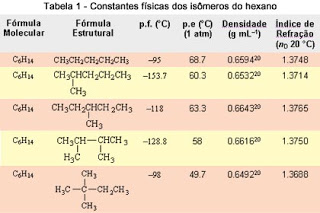
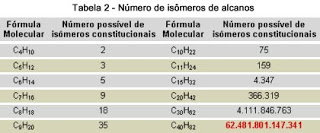
A Tabela 1 (abaixo) exemplifica esse fato, mostrando todos os cinco isômeros possíveis para o alcano com a fórmula molecular de C6H14, incluindo algumas propriedades físicas, como ponto de fusão (p.f.), ponto de ebulição (p.e.), densidade e índice de refração. A Tabela 2 mostra que, dependendo do número de carbonos, a quantidade de isômeros possíveis pode ser superior à de moléculas encontradas no universo.
Estereoisômeros
Existe outra classe de moléculas que apresentam a mesma fórmula molecular (portanto são isômeros), mas que não são classificadas como isômeros constitucionais. São os chamados estereoisômeros, cujos átomos são ligados na mesma sequência (a mesma constituição), mas diferem no arranjo de seus átomos no espaço.
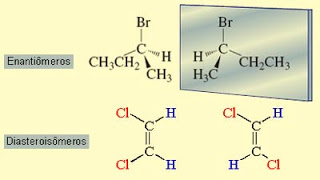
Os estereoisômeros podem ser subdivididos em duas categorias gerais: enantiômeros e diasteroisômeros. Os enantiômeros são estereoisômeros cujas moléculas são imagens especulares não superponíveis. Os diasteroisômeros são estereoisômeros cujas moléculas não são imagens especulares uma da outra.
Quando falamos em moléculas com imagens especulares não superponíveis (enantiômeros), falamos em termos de quiralidade. Um objeto quiral é aquele que possui a propriedade de "lateralidade", ou seja, é um objeto que não pode ser colocado sobre a sua imagem especular de forma que todas as partes coincidam. Em outras palavras, um objeto quiral não é superponível à sua imagem especular. O exemplo mais comum é cada uma das nossas mãos, que guardam a relação de imagem especular entre si (esquerda e direita), mas não podem ser sobrepostas. A mão é, portanto, um objeto quiral.
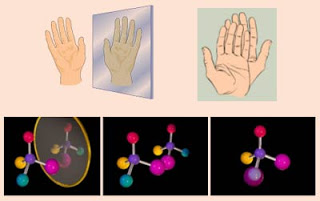
Existem muitos outros exemplos de objetos que são quirais: um pé de tênis, uma orelha, um parafuso de madeira, um carro, etc. O corpo humano é estruturalmente quiral, com o coração localizado à esquerda do centro e o fígado à direita. Muitas plantas mostram quiralidade na maneira de se enroscar ao redor de estruturas de suporte, como a madressilva, que se enrosca para a esquerda, enquanto uma trepadeira se enrosca para a direita. O DNA é uma molécula quiral, uma vez que a forma de hélice dupla do DNA gira para o lado direito.
A quiralidade tem uma importância muito grande no dia-a-dia. Muitos medicamentos são quirais. Normalmente, apenas uma forma de imagem especular de uma droga fornece o efeito desejado. A outra forma de imagem especular é geralmente inativa, menos ativa, ou mesmo nociva à saúde, provocando efeitos colaterais sérios ou toxicidade.
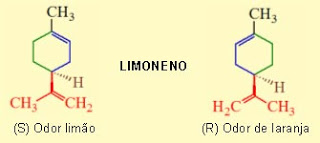
Mesmo os sentidos do paladar e do olfato também dependem, muitas vezes, da quiralidade. Uma forma especular de uma molécula quiral pode ter um determinado sabor ou odor, enquanto a sua imagem especular cheira e tem um sabor completamente diferente. Um exemplo é o caso da molécula do limoneno e de sua imagem especular, que têm fragrâncias muito distintas: uma molécula (o enantiômero S) ocorre no fruto dos pinheiros e tem odor semelhante ao da terebintina, enquanto o outro isômero (R) é responsável pelo cheiro característico das laranjas.
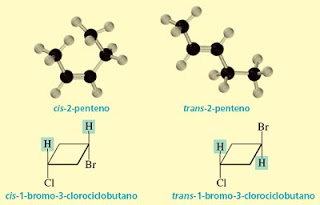
Como já foi dito, os diatereoisômeros são todos os outros estereoisômeros que não guardam entre si a relação de imagem especular. Os isômeros cis e trans de alcenos ou cicloalcanos enquadram-se nesta classe:
Então, voltando ao que dizíamos no início do texto, a gordura trans é um tipo específico de gordura, formado por um processo de hidrogenação natural (em animais) ou industrial, e pertence à classe dos ácidos graxos insaturados (que apresenta um tipo de isomeria). A designação "trans" vem de "transversos" e o nome é referente à ordem da cadeia de átomos do ácido graxo.
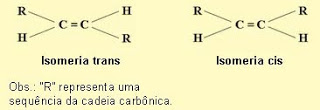
Assim, em um óleo encontrado na natureza, por exemplo, os átomos estão distribuídos em posição cis. No entanto, quando é submetido ao tratamento industrial de hidrogenação, a estrutura química do óleo é modificada, transformando-o em gordura, fazendo com que os ácidos graxos fiquem com os átomos em disposição "diagonal" - ou em alinhamento transversal (trans).
O consumo excessivo de gordura trans causa alterações no metabolismo lipídico. Aumenta o colesterol total e o LDL (colesterol ruim), além de diminuir o HDL (colesterol bom). Com o aumento do colesterol, pode acontecer a obstrução dos vasos sanguíneos, causando doenças cardiovasculares
Então, como vimos, há uma subdivisão de isômeros:
Isômeros - compostos diferentes com a mesma fórmula molecular.
a. Isômeros constitucionais - isômeros cujos átomos têm uma conectividade diferente.
b. Estereoisômeros - isômeros que têm a mesma conectividade, mas que diferem no arranjo de seus átomos no espaço.
- Enantiômeros - estereoisômeros que são imagens especulares não-superponíveis um do outro.
- Diasteroisômeros - estereoisômeros que não são imagens especulares um do outro
Fonte
K. P. C. Vollhardt, N. E. Schore. Química Orgânica - Estrutura e Função. 4ª Ed. - Porto Alegre: Bookman, 2004.
T. W. G. Solomons, C. B. Fryle. Química Orgânica - volume 1. 8ª Ed. - Rio de Janeiro: LTC, 2005.
P. Y. Bruice. Química Orgânica - volume 1. 4ª. Ed. - Rio de Janeiro: Pearson / Prentice Hall.
Erivanildo Lopes da Silva e Ricardo Lima Guimarães são professores do curso de Química da Universidade Federal da Bahia - campus ICADS-Barreiras.
- Isomeria
Professor de Matemática e Biologia Antônio Carlos Carneiro BarrosoColégio Estadual Dinah Gonçalvesemail [email protected] www.ensinodematemtica.blogspot.com.brwww.accbarrosogestar.blogspot.com.br WWW.profantoniocarneiro.com A descoberta...
- Lei De Avogadro
Do número de Avogadro, sabemos que há aproximadamente 6,02 x 1023 átomos/mol. Então, em 0,0142 mol temos : (0,0142 mol) x (6,02 x 1023 átomos/mol) = 8,55 x 1021átomos Volume molar de um gás CNTP: temperatura = 0 °C e pressão =1atm. É o volume...
- Hidrocarbonetos
Hidrocarbonetos são compostos formados exclusivamente de carbono e hidrogênio, que também são chamados hidrocarburetos, carboidretos, carbetos, carburetos ou carbonetos de hidrogênio. Os fogos sagrados de Baku, capital do Azerbaijão, situada à...
- Compostos Orgânicos Fórmulas Estruturais E Principais Classes
Professor de Matemática e Biologia Antônio Carlos Carneiro BarrosoColégio Estadual Dinah Gonçalvesemail [email protected] www.ensinodematemtica.blogspot.com.brwww.accbarrosogestar.blogspot.com.br WWW.profantoniocarneiro.com Os humanos...
- Carboidratos
Professor de Matemática e Biologia Antônio Carlos Carneiro BarrosoColégio Estadual Dinah Gonçalvesemail [email protected] www.ensinodematemtica.blogspot.com.brwww.accbarrosogestar.blogspot.com.br WWW.profantoniocarneiro.com ...
Matemática
Isomeria Isômeros de constituição e estereoisômeros
Professor de Matemática e Biologia Antônio Carlos Carneiro Barroso
Colégio Estadual Dinah Gonçalves
email [email protected]
www.ensinodematemtica.blogspot.com.br
www.accbarrosogestar.blogspot.com.br
WWW.profantoniocarneiro.com
Cada vez mais percebemos como a linguagem da química orgânica está fazendo parte do cotidiano das pessoas. Por exemplo, atualmente, qualquer pessoa que vai ao supermercado procura comprar alimentos sem gordura trans. Agora, o que é essa tal gordura trans?
Para responder, precisamos fazer uma viagem através da química orgânica.
Os químicos orgânicos dispõem de diversas técnicas de determinação da estrutura molecular. No caso do termo "trans", ele corresponde a um conjunto de moléculas cujas fórmulas empíricas são iguais. Quando isso acontece, tem-se a chamada isomeria. Então, vamos entender um pouco sobre esse tema.
Isômeros de constituição
Por exemplo, a fórmula molecular C2H6O: ela corresponde a duas substâncias conhecidas, o etanol e o metóxi-metano (éter dimetílico). Podemos distinguir essas duas substâncias com base nas suas propriedades físicas - seus pontos de fusão e ebulição (p.e.), índice de refração, etc. O etanol é um líquido (p.e. 78,5oC), muito usado como solvente nos laboratórios e na indústria, presente também nas bebidas alcoólicas. O éter dimetílico é um gás (p.e. - 23oC) usado como gás refrigerante, que substitui os Freons.
Moléculas como essas, cujas fórmulas moleculares são as mesmas, porém com as sequências dos átomos ligados diferentes, são chamadas de isômeros constitucionais ou de constituição.
Fórmula molecular: C2H6O
Etanol: CH3CH2OH
Éter dimetílico: CH3OCH3
Duas substâncias que ocorrem na natureza ilustram as consequências biológicas dessas diferenças estruturais. A prostaciclina I2 impede que o sangue coagule no sistema circulatório. A tromboxana A2, excretada quando ocorre um ferimento, induz à agregação plaquetária e à formação de coágulos sobre a ferida. Esses compostos também são isômeros constitucionais (têm a fórmula molecular C20H32O5) e sua conectividade não é muito diferente, tanto que são sintetizados no organismo a partir do mesmo material.
A classe dos alcanos comporta um grande e variado número de isômeros constitucionais, à medida que o número de átomos de carbonos aumenta. Por exemplo, butano e isobutano são isômeros constitucionais com a fórmula molecular de C4H10. Já a fórmula C5H12 possui três isômeros (pentano, isopentano e neopentano):

A Tabela 1 (abaixo) exemplifica esse fato, mostrando todos os cinco isômeros possíveis para o alcano com a fórmula molecular de C6H14, incluindo algumas propriedades físicas, como ponto de fusão (p.f.), ponto de ebulição (p.e.), densidade e índice de refração. A Tabela 2 mostra que, dependendo do número de carbonos, a quantidade de isômeros possíveis pode ser superior à de moléculas encontradas no universo.


Estereoisômeros
Existe outra classe de moléculas que apresentam a mesma fórmula molecular (portanto são isômeros), mas que não são classificadas como isômeros constitucionais. São os chamados estereoisômeros, cujos átomos são ligados na mesma sequência (a mesma constituição), mas diferem no arranjo de seus átomos no espaço.
Os estereoisômeros podem ser subdivididos em duas categorias gerais: enantiômeros e diasteroisômeros. Os enantiômeros são estereoisômeros cujas moléculas são imagens especulares não superponíveis. Os diasteroisômeros são estereoisômeros cujas moléculas não são imagens especulares uma da outra.

Quando falamos em moléculas com imagens especulares não superponíveis (enantiômeros), falamos em termos de quiralidade. Um objeto quiral é aquele que possui a propriedade de "lateralidade", ou seja, é um objeto que não pode ser colocado sobre a sua imagem especular de forma que todas as partes coincidam. Em outras palavras, um objeto quiral não é superponível à sua imagem especular. O exemplo mais comum é cada uma das nossas mãos, que guardam a relação de imagem especular entre si (esquerda e direita), mas não podem ser sobrepostas. A mão é, portanto, um objeto quiral.

Existem muitos outros exemplos de objetos que são quirais: um pé de tênis, uma orelha, um parafuso de madeira, um carro, etc. O corpo humano é estruturalmente quiral, com o coração localizado à esquerda do centro e o fígado à direita. Muitas plantas mostram quiralidade na maneira de se enroscar ao redor de estruturas de suporte, como a madressilva, que se enrosca para a esquerda, enquanto uma trepadeira se enrosca para a direita. O DNA é uma molécula quiral, uma vez que a forma de hélice dupla do DNA gira para o lado direito.
A quiralidade tem uma importância muito grande no dia-a-dia. Muitos medicamentos são quirais. Normalmente, apenas uma forma de imagem especular de uma droga fornece o efeito desejado. A outra forma de imagem especular é geralmente inativa, menos ativa, ou mesmo nociva à saúde, provocando efeitos colaterais sérios ou toxicidade.
Mesmo os sentidos do paladar e do olfato também dependem, muitas vezes, da quiralidade. Uma forma especular de uma molécula quiral pode ter um determinado sabor ou odor, enquanto a sua imagem especular cheira e tem um sabor completamente diferente. Um exemplo é o caso da molécula do limoneno e de sua imagem especular, que têm fragrâncias muito distintas: uma molécula (o enantiômero S) ocorre no fruto dos pinheiros e tem odor semelhante ao da terebintina, enquanto o outro isômero (R) é responsável pelo cheiro característico das laranjas.

Como já foi dito, os diatereoisômeros são todos os outros estereoisômeros que não guardam entre si a relação de imagem especular. Os isômeros cis e trans de alcenos ou cicloalcanos enquadram-se nesta classe:

Então, voltando ao que dizíamos no início do texto, a gordura trans é um tipo específico de gordura, formado por um processo de hidrogenação natural (em animais) ou industrial, e pertence à classe dos ácidos graxos insaturados (que apresenta um tipo de isomeria). A designação "trans" vem de "transversos" e o nome é referente à ordem da cadeia de átomos do ácido graxo.

Assim, em um óleo encontrado na natureza, por exemplo, os átomos estão distribuídos em posição cis. No entanto, quando é submetido ao tratamento industrial de hidrogenação, a estrutura química do óleo é modificada, transformando-o em gordura, fazendo com que os ácidos graxos fiquem com os átomos em disposição "diagonal" - ou em alinhamento transversal (trans).
O consumo excessivo de gordura trans causa alterações no metabolismo lipídico. Aumenta o colesterol total e o LDL (colesterol ruim), além de diminuir o HDL (colesterol bom). Com o aumento do colesterol, pode acontecer a obstrução dos vasos sanguíneos, causando doenças cardiovasculares
Então, como vimos, há uma subdivisão de isômeros:
Isômeros - compostos diferentes com a mesma fórmula molecular.
a. Isômeros constitucionais - isômeros cujos átomos têm uma conectividade diferente.
b. Estereoisômeros - isômeros que têm a mesma conectividade, mas que diferem no arranjo de seus átomos no espaço.
- Enantiômeros - estereoisômeros que são imagens especulares não-superponíveis um do outro.
- Diasteroisômeros - estereoisômeros que não são imagens especulares um do outro

Fonte
K. P. C. Vollhardt, N. E. Schore. Química Orgânica - Estrutura e Função. 4ª Ed. - Porto Alegre: Bookman, 2004.
T. W. G. Solomons, C. B. Fryle. Química Orgânica - volume 1. 8ª Ed. - Rio de Janeiro: LTC, 2005.
P. Y. Bruice. Química Orgânica - volume 1. 4ª. Ed. - Rio de Janeiro: Pearson / Prentice Hall.
Erivanildo Lopes da Silva e Ricardo Lima Guimarães são professores do curso de Química da Universidade Federal da Bahia - campus ICADS-Barreiras.
- Isomeria
Professor de Matemática e Biologia Antônio Carlos Carneiro BarrosoColégio Estadual Dinah Gonçalvesemail [email protected] www.ensinodematemtica.blogspot.com.brwww.accbarrosogestar.blogspot.com.br WWW.profantoniocarneiro.com A descoberta...
- Lei De Avogadro
Do número de Avogadro, sabemos que há aproximadamente 6,02 x 1023 átomos/mol. Então, em 0,0142 mol temos : (0,0142 mol) x (6,02 x 1023 átomos/mol) = 8,55 x 1021átomos Volume molar de um gás CNTP: temperatura = 0 °C e pressão =1atm. É o volume...
- Hidrocarbonetos
Hidrocarbonetos são compostos formados exclusivamente de carbono e hidrogênio, que também são chamados hidrocarburetos, carboidretos, carbetos, carburetos ou carbonetos de hidrogênio. Os fogos sagrados de Baku, capital do Azerbaijão, situada à...
- Compostos Orgânicos Fórmulas Estruturais E Principais Classes
Professor de Matemática e Biologia Antônio Carlos Carneiro BarrosoColégio Estadual Dinah Gonçalvesemail [email protected] www.ensinodematemtica.blogspot.com.brwww.accbarrosogestar.blogspot.com.br WWW.profantoniocarneiro.com Os humanos...
- Carboidratos
Professor de Matemática e Biologia Antônio Carlos Carneiro BarrosoColégio Estadual Dinah Gonçalvesemail [email protected] www.ensinodematemtica.blogspot.com.brwww.accbarrosogestar.blogspot.com.br WWW.profantoniocarneiro.com ...
