Matemática
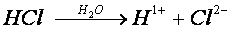



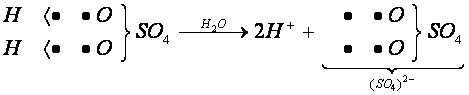




 O Na2SO4, ao ser dissolvido em água, dá origem a dois íons Na+ e a um íon (SO4)2-.
O Na2SO4, ao ser dissolvido em água, dá origem a dois íons Na+ e a um íon (SO4)2-.
- Óxidos
Óxidos são substâncias que possuem oxigênio ligado a outro elemento químico, eles são compostos binários, isto é, são substâncias formadas pela combinação de dois elementos. Um desses elementos é sempre o oxigênio (O). Classificação dos...
- Óxidos
Os óxidos são compostos binários, isto é, são substâncias formadas pela combinação de dois elementos, um deles é o oxigênio (que é o mais eletronegativo entre eles). Os óxidos se classificam em função do seu comportamento na presença de...
- Funções Químicas
Professor de Matemática e Biologia Antônio Carlos Carneiro BarrosoColégio Estadual Dinah Gonçalvesemail [email protected] www.ensinodematemtica.blogspot.com.brwww.accbarrosogestar.blogspot.com.br WWW.profantoniocarneiro.com ...
- Bases
BasesLíria Alves As bases fazem parte da produção do papelO cientista Svant August Arrhenius, no ano de 1887, realizou inúmeros experimentos com substâncias diluídas em água e chegou à seguinte definição para bases: Base...
- Classificação Dos óxidos
Classificação dos óxidosPor Líria Alves Água oxigenadaÓxidos são compostos binários, ou seja, formados pela combinação de dois elementos, sendo um deles oxigênio. Classificação dos óxidos em função do comportamento...
Matemática
Funções Químicas
Função ácido
Uma das características da função ácido é a presença, nas substâncias classificadas nessa função, do elemento químico hidrogênio ligado a ametais. Um exemplo de ácido é o ácido clorídrico (HCl), que está presente em nosso estômago, auxiliando na digestão.
Existem ácidos que possuem mais de dois elementos químicos em sua composição e destacam-se pela presença do elemento oxigênio. São exemplos o ácido nítrico (HNO3) e o ácido sulfúrico (H2SO4).
Os elementos químicos que participam da composição dos ácidos tendem a ganhar elétrons, por isso eles são compostos formados por ligações covalentes, ou seja, não são substâncias iônicas, mas, sim, moleculares.
No entanto, nem todas as substâncias que possuem hidrogênio em sua composição podem ser classificadas como ácidas. Somente as substâncias que sofrem ionização liberando o cátion H+ são consideradas ácidos. A ionização consiste na formação de íons por quebra de uma ligação covalente.
Observe a seguir esse comportamento nos ácidos.
Ionização dos ácidos
A ionização é uma característica comum a todos os ácidos. Quando estes são dissolvidos em água, quebra-se a ligação do elemento ligado ao hidrogênio, liberando-o na forma de cátion H+.
Veja, nas equações representadas abaixo, como isso ocorre.
Equação química é a representação, de uma reação química por meio dos símbolos das espécies participantes (átomos, moléculas, íons etc.).
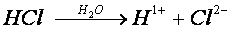
Ao ser dissolvido na água, o ácido clorídrico se ioniza, produzindo íons livres H+ e Cl-. Quando ocorre a quebra de ligação H – Cl, o elétron do hidrogênio fica com o cloro. Por esse motivo, o hidrogênio assume a carga +1, e o cloro assume a carga -1.


Na ionização de ácidos com mais de um átomo de hidrogênio, para cada ligação quebrada, o ânion originado assume uma carga negativa a mais. Observe o exemplo:

Ao ser dissolvido em água, o ácido sulfúrico ioniza-se, produzindo íons livres H+ e (SO4)2-. O ânion originado assume a carga -2, pois são liberados dois íons H+ na ionização do ácido.
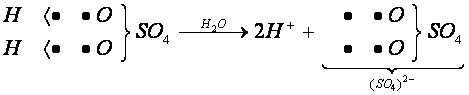
Os ácidos são compostos moleculares que se ionizam em presença de água, liberando cátion H+ na solução.
Classificação dos ácidos quanto a presença ou não de oxigênio em sua molécula
Dependendo de sua composição, podemos classificar os ácidos em: | Oxiácidos Existem ácidos que possuem o elemento oxigênio em sua composição, como por exemplo, o ácido nítrico (HNO3) e o ácido sulfúrico (H2SO4), substâncias muito utilizadas na indústria química. Esses ácidos são chamados de oxiácidos. | |
 | Hidrácidos São ácidos que não possuem o elemento oxigênio em sua composição. Podemos citar o ácido clorídrico (HCl), presente em nosso estômago, e o gás sulfídrico (H2S), um gás tóxico produzido em determinadas reações químicas. |
Os ácidos em nosso dia-a-dia
Em nosso cotidiano, estamos em contato com várias substâncias ácidas: o ácido cítrico, componente de várias frutas de sabor azedo, como o limão; o ácido acético, presente no vinagre, o ácido carbônico, presente nos refrigerantes e nas águas minerais gasosas, o ácido fosfórico, presente em refrigerantes à base de cola e em alguns medicamentos que possuem ácido acetilsalicílico (AAS) em sua formulação.
 |  |
Função base (ou hidróxido)
A função base é caracterizada por substâncias que apresentam o grupo hidroxila (OH)-1 ligado a metais. Devido a presença desse grupo, essas substâncias são também chamadas de hidróxidos. Um exemplo dessa função é a cal hidratada, utilizada em pinturas de paredes, cuja fórmula é Ca(OH)2.
As bases são formadas pela ligação iônica do ânion hidroxila (OH)- com um metal; são, portanto, compostos iônicos.
Existe, no entanto, um exceção, que é o hidróxido de amônio (NH4OH), uma base que não possui um metal em sua fórmula, apesar de ser um composto iônico.
Nas bases, o ânion hidroxila apresenta um átomo de hidrogênio ligado a um átomo de oxigênio por compartilhamento de elétrons (ligação covalente); esse ânion hidroxila tem carga -1, portanto forma uma ligação iônica com um cátion.
Por isso, quando isolado esse ânion apresenta carga -1. Observe:

Dissociação das bases
Da mesma forma que, em presença de água, os ácidos produzem por ionização o cátion H+, para que uma substância pertença à função base é necessário que, ao ser adicionada à água, produza como ânion exclusivamente a hidroxila (-OH).
Veja as equações a seguir:

Ao ser dissolvido em água, o hidróxido de sódio (NaOH) se dissocia, originando íons livres Na+ e OH-.
| Diferença de ionização e dissociação |
|---|
| Ionização é a formação de íons por quebra de uma ligação covalente. Ou seja, a substância de origem não é formada por íons e, após a quebra da ligação covalente, eles são produzidos. |
| Dissociação é o termo aplicado a compostos iônicos, isto é, consiste na separação dos íons que já existem nessas substâncias por algum processo. |
A dissociação pode ocorrer também entre bases com mais de uma hidroxila.

Nesse exemplo, além do cátion Ca2+, são liberadas duas hidroxilas na dissociação do hidróxido de cálcio.
As bases são compostos iônicos que se dissociam em presença de água, liberando ânion (OH)- em solução.
As bases no nosso dia-a-dia
Algumas bases são encontradas nas substâncias usadas em nosso cotidiano:- hidróxido de magnésio (Mg(OH)2), presente no leite de magnésia utilizado para combater a acidez estomacal;
- cal hidratada (Ca(OH)2), usada como argamassa na construção civil;
- hidróxido de sódio (NaOH), utilizado para a limpeza de materiais, no desentupimento de canos e largamente empregado na indústria;
- hidróxido de amônio (NH4OH), componente de vários produtos de limpeza vendidos no comércio.
Os indicadores ácido-base e o pH
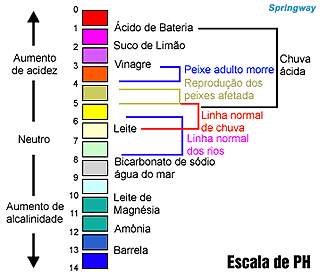 | Algumas substâncias apresentam comportamento distintos na presença de ácidos ou de bases. Entre elas, há um grupo de substâncias que assume diferentes colorações em função de o meio em que se encontram ser ácido ou básico. As substâncias pertencentes a esse grupo são chamadas indicadores ácido-base. Há uma escala numérica denominada pH, com valores entre 0 e 14, que indica se o meio á ácido, básico ou neutro. Os valores de pH são calculados matematicamente considerando as concentrações de H- e (OH) presentes em uma solução. O pH significa potencial hidrogeniônico. Quanto menor o valor do pH maior a acidez. Em contrapartida, quando maior o valor do pH, maior a basicidade. É comum, em substituição ao termo basicidade, ser utilizado o termo alcalinidade. |
| A escala de pH serve para medir o nivel de ácido-base. Se o nivel for entre 0 e 6, é ácido ou alcalino. Se for 7 é neutro. E se for entre 8-14, a solução é básica. |
|---|
Os indicadores são substâncias que mudam de cor em função do valor do pH, podendo, assim, servir como parâmetro para indicar em que a faixa de pH uma determinada amostra se encontra. Por exemplo, a fenoftaleína é um indicador que, em meio ácido ou neutro, apresenta-se incolor; quando em meio básico, torna-se avermelhada. Os indicadores não informam o valor exato do pH de uma solução, apenas fornecem dados para avaliar se o meio encontra-se ácido, básico ou neutro. Para saber o valor exato do pH, utiliza-se um equipamento especial, o pHmetro (peagâmetro). É possível misturar ácidos com bases até conseguir um pH neutro. Esse processo chama-se neutralização e consistem em um tipo de reação química. |  |
Função sal
A função sal é caracterizada por compostos iônicos que apresentam, ao menos, um cátion diferente de H+ e, no mínimo, um ânion diferente de (OH)-. Exemplos: o sal de cozinha (NaCl), o mármore (CaCO3), o gesso (CaSO4), entre outras substâncias.
Uma característica importante dos sais é que eles podem ser obtidos da reunião entre ácidos e bases.

Os sais compostos encontrados na natureza no estado sólido geralmente sob a forma de minerais, ou dissolvidos, como no caso do cloreto de sódio ou sal de cozinha (NaCl) presente na água do mar.
Muitos sais apresentam sabor salgado, alguns apresentam alta solubilidade em água, e outros apresentam valores de solubilidade tão pequenos que não considerados insolúveis, como é o caso do carbonato de cálcio (CaCO3), um constituinte do mármore.
Quando um sal se dissolve em água, ele sofre uma dissociação semelhante à que ocorre com as bases, visto que também é um composto iônico e, nessas dissociação, são liberados íons.
O NaCl, ao ser dissolvido em água, sofre dissociação, originando os íons livres Na+ e Cl-. Normalmente, sais que contêm um metal em sua composição, apresentam-no ligado ao restante da estrutura por ligação iônica. Nessa ligação ocorre a quebra e a conseqüente separação dos íons.

Sais são compostos iônicos que possuem pelo menos um cátion diferente de H+ e, no mínimo, um ânion diferente de (OH)-.
Os sais são importantes no funcionamento do nosso organismo. Atuam, por exemplo, regulando a quantidade de água nas células e como constituintes de ossos e dentes.
Função óxido
Os óxidos são compostos formados por apenas dois elementos químicos (compostos binários), em que obrigatoriamente um deles precisa ser o oxigênio.
Os dois exemplos mais característicos de óxidos são a água (H2O), presente em quase tudo em nosso planeta, e o gás carbônico (CO2), utilizado, por exemplo, pelos seres produtores das cadeias alimentares, no processo da fotossíntese.
Compostos binários formados por oxigênio e flúor não são considerados óxidos, pois suas propriedades se diferenciam dos óxidos em geral.
Os óxidos podem ser formados pela combinação do oxigênio com quase todos os elementos da tabela periódica, metais e ametais. São encontrados sob a forma de inúmeros minerais, destacando-se o minério de ferro (Fe2O3), chamado hematita, e o minério de alumínio (Al2O3), chamado bauxita. Esses minérios são utilizados na obtenção de ferro e de alumínio metálicos.
Óxidos são compostos binários formados por oxigênio e por outro elemento químico diferente do flúor.
Principais Óxidos e suas utilizações:
Peróxidos: na indústria são usados como clarificadores (alvejantes) de tecidos, poupa de celulose, etc. Para essas utilizações sua concentração é superior a 30% de peróxido de hidrogênio. A solução aquosa com concentração de 3% de peróxido de hidrogênio, popularmente conhecida como água oxigenada, é usada como anti-séptico e algumas pessoas a utilizam para a descoloração de pêlos e cabelos. |
Dióxido de silício: é o óxido mais abundante da crosta terrestre, ele é um dos componentes dos cristais, das rochas e da areia. |
Óxido de Cálcio (CaO): Obtido a partir da decomposição do calcário, é usado na agricultura para diminuir a acidez do solo e também na preparação de argamassa na construção civil. |
Óxido Nitroso (N2O): Conhecido como gás hilariante, esse óxido inalado em pequena quantidade provoca euforia, mas pode causar sérios problemas de saúde; é utilizado como anestésico. |
Dióxido de Enxofre (SO2): É usado para a obtenção de ácido sulfúrico e no branqueamento de óleos alimentícios, entre outras aplicações. É um dos principais poluentes atmosféricos; em dias úmidos, combina-se com o vapor de água da atmosfera e origina a chamada chuva ácida. |
Monóxido de Carbono (CO): Usado para obter certos produtos químicos e na metalurgia do aço. É normalmente o principal poluente da atmosfera das zonas urbanas; inalado combina com a hemoglobina das hemácias do sangue, neutralizando-as para o transporte de gás oxigênio no organismo. |
www.sobiologia.com.br
- Óxidos
Óxidos são substâncias que possuem oxigênio ligado a outro elemento químico, eles são compostos binários, isto é, são substâncias formadas pela combinação de dois elementos. Um desses elementos é sempre o oxigênio (O). Classificação dos...
- Óxidos
Os óxidos são compostos binários, isto é, são substâncias formadas pela combinação de dois elementos, um deles é o oxigênio (que é o mais eletronegativo entre eles). Os óxidos se classificam em função do seu comportamento na presença de...
- Funções Químicas
Professor de Matemática e Biologia Antônio Carlos Carneiro BarrosoColégio Estadual Dinah Gonçalvesemail [email protected] www.ensinodematemtica.blogspot.com.brwww.accbarrosogestar.blogspot.com.br WWW.profantoniocarneiro.com ...
- Bases
BasesLíria Alves As bases fazem parte da produção do papelO cientista Svant August Arrhenius, no ano de 1887, realizou inúmeros experimentos com substâncias diluídas em água e chegou à seguinte definição para bases: Base...
- Classificação Dos óxidos
Classificação dos óxidosPor Líria Alves Água oxigenadaÓxidos são compostos binários, ou seja, formados pela combinação de dois elementos, sendo um deles oxigênio. Classificação dos óxidos em função do comportamento...
